서 론
재료 및 방법
자포니카 계통 육성
병해충 저항성 생물 검정
병 저항성 유전자 분자표지 검정
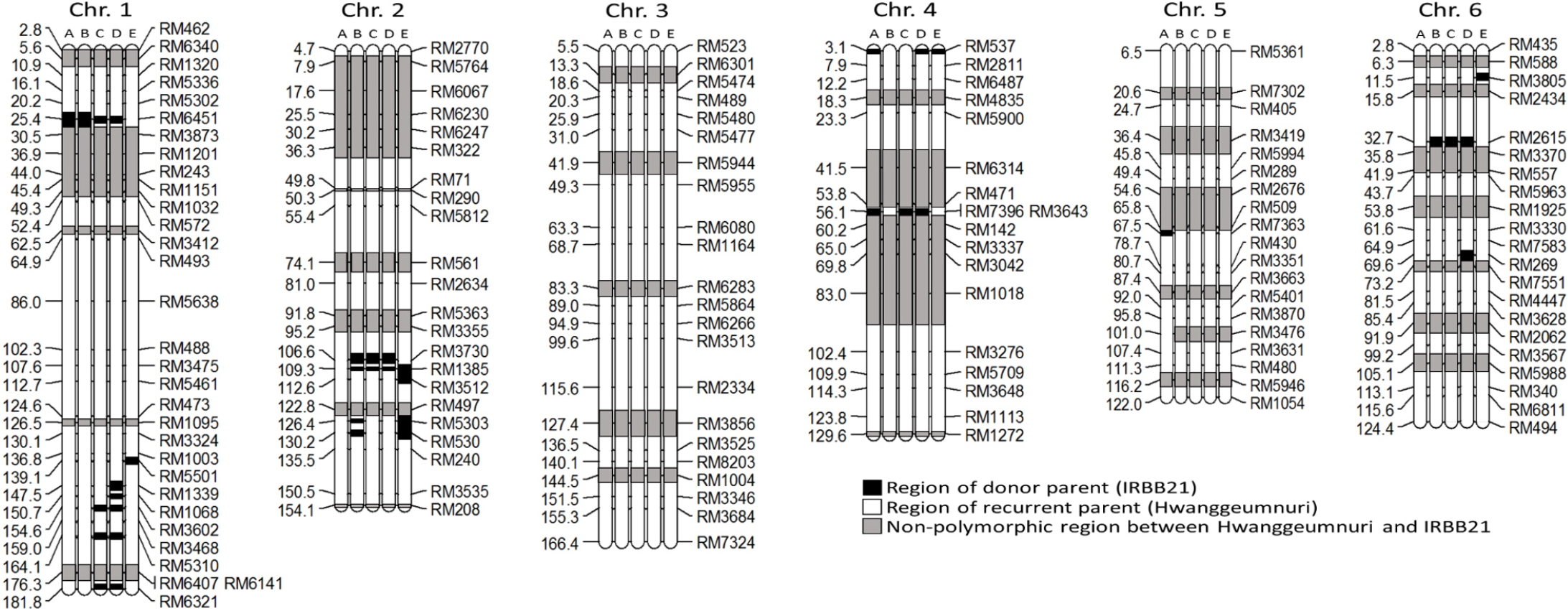
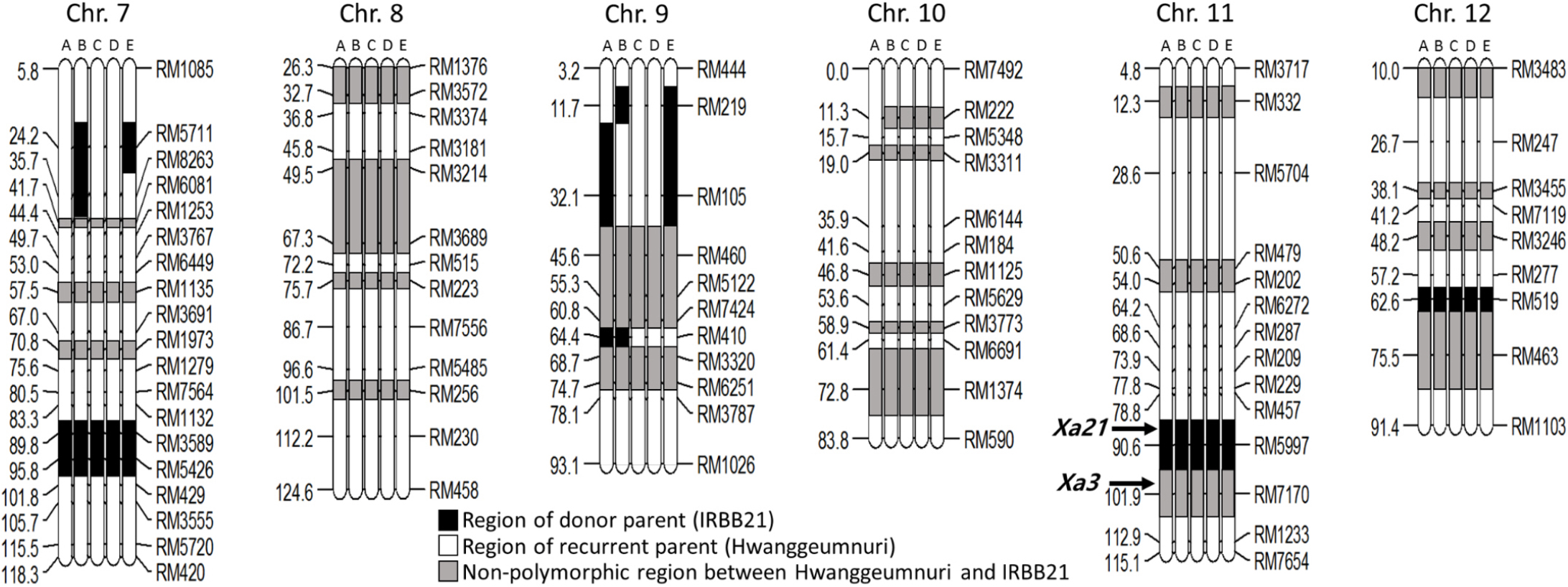
ABLs21의 염색체단편 이입 분석
통계분석
결과 및 고찰
Advanced backcross lines 21 계통 육성
ABLs21의 기타 병해충 저항성
벼 흰잎마름병 저항성 유전자 집적효과
ABLs21의 모부본 염색체단편 이입 분석
적 요
서 론
벼 흰잎마름병은 벼 재배지역이 많은 온대와 열대의 아시아에서 주로 발생한다. 발병 단계 및 지리적인 위치에 따라 50%까지 수량손실을 가져오는 병 중 하나이다(Mew et al., 1992). 이 병은 1884년 일본에서 최초로 발견된 후 감수성 품종의 보급과 함께 급속도로 확산되었다. 우리나라의 벼 흰잎마름병 발병 추이를 보면 1930년 전남 해남에서 최초로 발견된 후(Takeuchi, 1930) 1979년 42.5%까지 발생하였고 1990년대에는 관개수로 정비 등으로 인한 월동기주의 제거로 발병이 현저히 줄어들었다(Shin et al., 2005). 2006년 34,764 ha (3.6%)가 발병되어 갑작스런 증가를 보인 후 2010년대에는 매년 벼 재배면적의 약 1.4% 정도 발생하고 있다(NCPMS: National Crop Pest Management System, http:// ncpms.rda.go.kr/npms).
병 발생비율과 병원균 균주의 변이는 재식품종의 비율과 깊은 상관관계가 있다(Choi et al., 1981). 우리나라의 경우 1991년 최초의 Xa3 유전자를 가진 화영벼가 육성된 이후 10대 품종 중 Xa3 유전자 보유 품종의 재배면적이 1990년대(’94~’99) 61,964 ha (6%)에서 2000년대(’00~’09) 244,693 (26%), 2010년대(’10~’15) 401,317 (48%)로 증가 하였다. 2000년 이후 Xa3 유전자 보유 품종의 점유율 확대와 K3·K3a 레이스의 우점시기의 일치는 품종과 병원균의 상관관계를 잘 보여주고 있으며, 2003년 K3 레이스의 변이균 K3a의 출현으로 기존 K3 저항성 품종의 이병화가 급속하게 이루어지고 있다(Noh et al., 2003, 2013; Kang et al., 2015, NCPMS).
기존 품종의 이병화로 K3a 균주에 저항성을 갖는 품종의 개발 필요성은 점차 증가하고 있다. 2016년 K3a 균주까지 저항성인 품종은 9개 품종으로 벼 흰잎마름병 저항성 유전자 분포는 신진백(Xa3+xa5+Xa21)과 중간모본 철원92RI (Xa4+xa5+Xa21)을 제외하면 강백, 진백, 신백, 해품, 안백, 만백, 새신 7개 품종 모두 Xa3+xa5 유전자를 보유하여 유전자 다양성 면에서도 매우 낮은 상황이다(RDA, 1992~2016).
육성된 저항성 품종은 발병상습지 등에 재배되어 수량손실을 최소화 할 수 있다. 벼 흰잎마름병에 의한 벼 수량손실은 기상조건, 품종, 병발생시기에 따라 다르지만 평균 10~30%, 심할 경우 50% 이상으로 보고 있다(Ou, 1985). 열대지방에서는 Kresek에 걸릴 경우 유묘 단계에서 모두 고사하기 때문에 80% 이상의 피해가 발생할 수 있다(Inoue & Tsuda, 1960, Mew et al., 1993). 일반적으로 벼 생육기 중 최대분얼기와 수잉기 때 감염에 매우 민감하며 수량 손실이 크다(Ho & Lim, 1976; Kaul & Sharma, 1987). Noh et al. (2008)은 벼 흰잎마름병 발병상습지에 자포니카 감수성 품종 남평과 저항성 품종 진백을 재배한 결과 수량이 각각 352 kg/10a, 540 kg/10a로 65%의 차이를 보이는 결과를 얻었다. Vera Cruz et al. (2000)은 단일 저항성 유전자를 가진 품종은 병원균의 변이 및 새로운 균주 출현에 급속히 약화되기 쉬운 단점을 가지고 있다고 하였다. 이처럼 단일저항성유전자(Xa3) 보유 품종의 재배면적 확대에 따른 특정 레이스(K3)의 우점과 변이균(K3a)의 발생은 저항성 안정화와 저항성 품종 개발 대응에 큰 어려움을 발생시키고 있으며 이에 K3a 균주 뿐만 아니라 K4, K5에 대응한 다양한 유전자가 집적된 품종의 개발은 벼 육종 기간이 10년 이상 소요되는 만큼 미래에 대비해 매우 중요한 일이다.
따라서 본 연구는 유전자의 확대와 집적을 통해 벼 흰잎마름병에 대응하는 저항성 계통을 육성하고, 육성계통에 대한 주요 농업형질, 벼 흰잎마름병원균 저항성반응, 염색체단편 이입을 분석하여 저항성 품종 육종에 대한 기초자료를 제공하고자 하였다.
재료 및 방법
자포니카 계통 육성
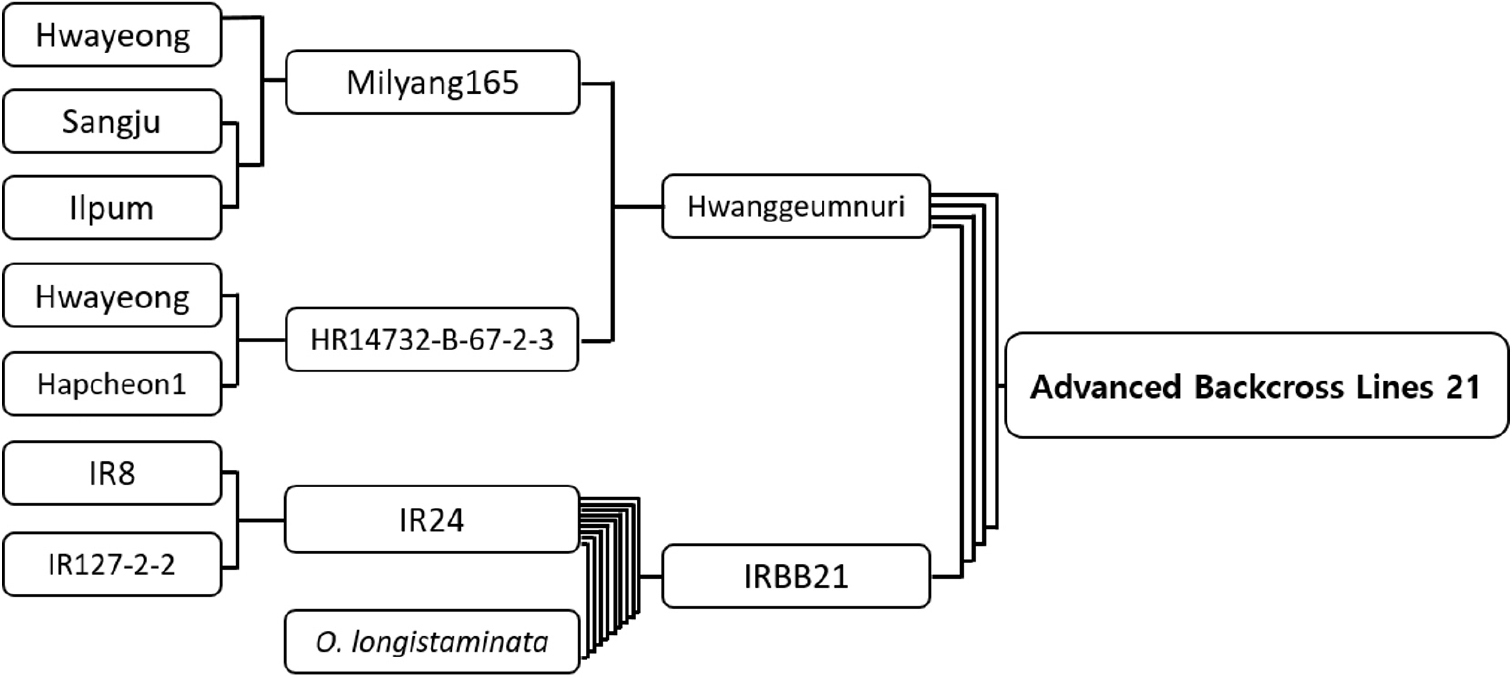
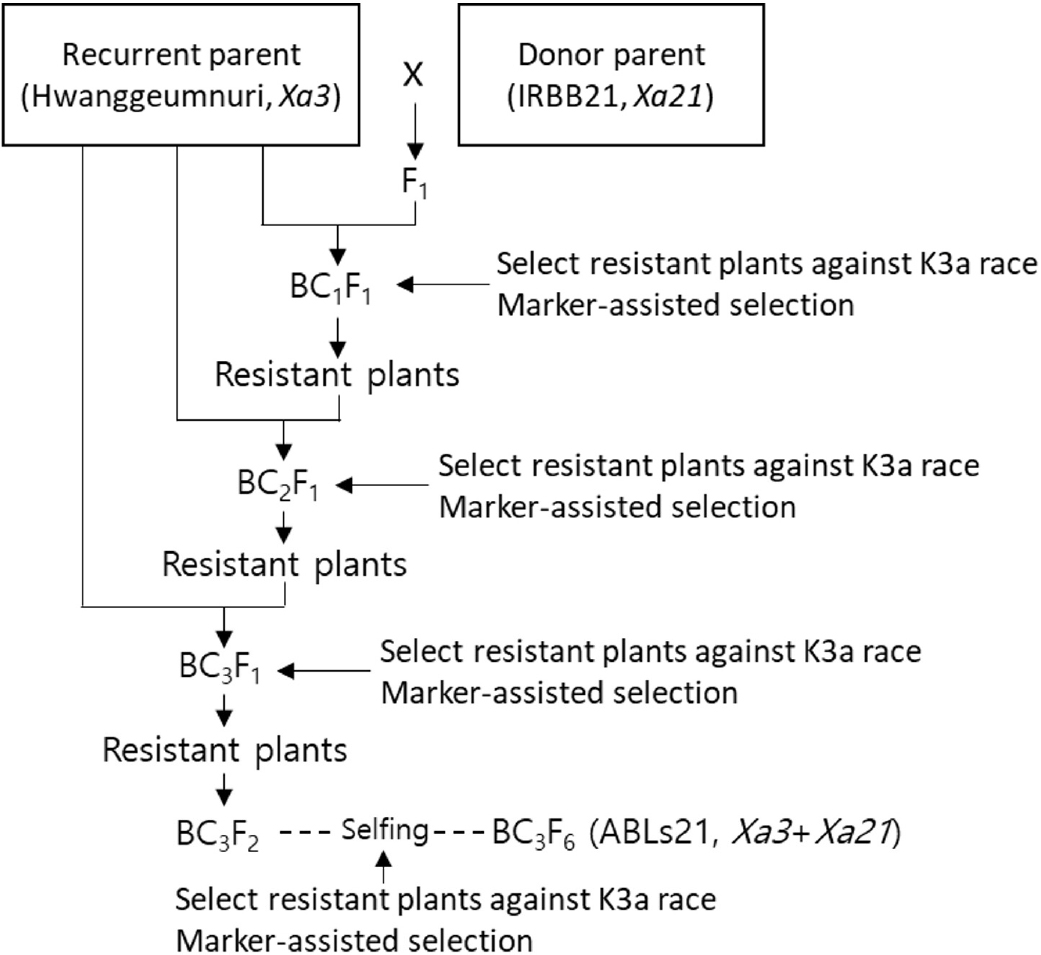
여교배를 통한 진전 된 내병성벼 계통(Advanced Backcross Lines; ABLs) ABLs21을 육성하기 위해 중만생종이며 Xa3 유전자를 보유한 고품질 품종 황금누리와 IR24에 Xa21 유전자를 보유한 O. longistaminata를 4번 여교배하여 육성된 근동질유전자계통 IRBB21을 모부본으로 인공교배하여 F1을 각각 양성하였다. 양성된 F1을 다시 황금누리와 교배하여 BC1F1을 만든 후 우리나라 벼 흰잎마름병원균 K3a (HB1009) 레이스로 접종하여 저항성 반응을 나타낸 계통을 선발하였다. 선발된 BC1F1을 다시 황금누리로 교배하여 BC2F1을 만들고 K3a 레이스로 접종하여 저항성 검정하였다. 황금누리/IRBB21 후대는 이 과정을 한번 더 반복하여 BC3F1을 만들었다. 이후 세대진전하여 BC3F2 세대에서는 집단선발법을, BC3F3 이후부터는 계통육종법으로 선발하였고 내병충성 특성검정은 벼 흰잎마름병검정(K3a 레이스), 도열병 밭못자리검정, 벼멸구 유묘검정을 실시하였다. BC3F5 세대에서는 벼 흰잎마름병 저항성 유전자 Xa3·Xa21, 줄무늬잎마름병 저항성 유전자 Stv-bi 보유여부를 분자표지로 확인하였다. 최종적으로 BC3F6 세대에서 5계통을 선발하였다(Table 1).
Table 1.
List of recurrent/donor parents, ABLs21, and check varieties used in this study.
| Variety | Description (generation) | Resistance Gene | Remarks |
| Hwanggeumnuri | Recurrent parent | Xa3 | Korean elite Japonica variety |
| IRBB21 | Donor parent | Xa21 | Near-isogenic line, Indica |
| HR28291-21-1-4 | BC3F6 | Xa3+Xa21 | Advanced backcross line 21-1 |
| HR28291-21-3-2 | BC3F6 | Xa3+Xa21 | Advanced backcross line 21-2 |
| HR28291-21-3-3 | BC3F6 | Xa3+Xa21 | Advanced backcross line 21-3 |
| HR28291-21-4-3 | BC3F6 | Xa3+Xa21 | Advanced backcross line 21-4 |
| HR28291-21-5-1 | BC3F6 | Xa3+Xa21 | Advanced backcross line 21-5 |
| ABLs21z) | |||
| Nampyeong | Check | None | Susceptible check |
| Anbaeg | Check | Xa3+xa5 | Resistant check |
BC3F2에서 BC3F4까지는 생물검정으로 만 선발을 하였고 전개한 BC3F5 50계통을 생물검정과 분자표지를 사용하여 저항성 유전자 보유 여부를 확인한 결과 모든 계통에서 Xa3와 Xa21 유전자가 검출됐으며 이들 중 외관 표현형질과 미질이 나쁘며 이형접합계통은 도태하였다. 벼흰잎마름병 저항성 비교품종으로 저항성 유전자가 없는 남평과 저항성 유전자 Xa3와 xa5를 가진 안백을 사용하였다.
병해충 저항성 생물 검정
벼 흰잎마름병 저항성 실험에 사용한 균주는 국립식량과학원에서 분양받은 우리나라 벼 흰잎마름병 균주 HB1013 (K1), HB1014 (K2), HB1015 (K3), HB1009 (K3a), HB3079 (K4), HB4044 (K5)를 PS (Potato Sucrose) 액체배지에 28°C 항온진탕기로 3일간 배양한 후 멸균수로 희석하여 분광광도계(Ultrospec 4300 pro. UK)로 병원균 농도를 108~109 cells/ml로 조정하여 접종에 사용하였다. 계통육성시험과 생산력검정시험 특성검정은 3반복으로 HB1009 (K3a) 균주를 최고분얼기에 잎 선단 5 cm 부위를 가위절엽 접종하고 3주 후에 가장 긴 병반을 보인 3개 엽의 병반장을 측정하여 평균 병반장 길이가 1 cm 이하는 고도저항성(HR; highly resistant), 5 cm 미만은 저항성(R; resistant), 5~9 cm는 중도저항성(MR; moderately resistant), 10 cm 이상은 감수성(S; susceptible)으로 구분하였다(RDA, 2012).
잎도열병 밭못자리 검정은 전주, 상주, 운봉, 철원, 계화 5개 지역에서 실시하여 잎도열병에 매우 약한 계통은 도태시켰다.
벼멸구 유묘기 저항성 검정은 재료를 파종하고 4~5엽기에 유묘 개체 당 2~3령의 벼멸구 유충을 10마리씩 접종하였다. 충 접종 후 감수성 품종인 남평벼가 완전히 고사한 시점에 검정재료의 저항성 정도를 전 개체 중 0~20% 고사하면 강(R), 30~50% 고사하면 중강(MR), 60~70% 고사하면 중약(MS), 80~100% 고사하면 약(S)으로 조사 판정하였다(RDA, 2012).
병 저항성 유전자 분자표지 검정
Marker-assisted selection (MAS)를 활용하여 저항성 계통을 육성하기 위해 탐침하고자 하는 저항성 유전자의 선발이 용이한 분자표지를 선발하였다. 모본 황금누리와 부본 IRBB21의 벼 흰잎마름병 저항성 유전자는 기존의 연구를 통해 이미 알려져 있어 해당 분자표지의 PCR을 통해 확인하였다.
Genomic-DNA는 계통별 파종 후 2~3엽기의 어린잎을 1 cm 크기로 잘라 마쇄한 후 Biosprint 96 (Qiagen Co., Germany) DNA plant kit를 활용하여 추출하였고 분광광도계(Biospec- nano, Shimadzu Co., Japan)으로 농도를 측정하여 10 ng/ul로 조절하여 사용하였다. 저항성 유전자를 확인하기 위해 연관된 마커를 사용하였다(Table 2). 벼 흰잎마름병 저항성 유전자 Xa3는 9643.T4, Xa21은 U1/I1을 사용하였다. 줄무늬잎마름병 저항성 유전자 Stv-bi는 Indel7 마커를 사용하였다(Kwon et al., 2012). PCR (Bio-Rad, PTC-200 Thermocycler, Germany) 증폭 조건은 U1/I1는 pre-denaturation 95°C 4분간 1회, denaturation 95°C 30초, annealing 65°C (10603.T10Dw)/ 56°C (U1/I1) 30초, extension 72°C 1분을 35회, final-extension 72°C 10분을 하였다. Indel7은 pre-denaturation 94°C 5분간 1회, denaturation 94°C 30초, annealing 58°C 30초, extension 72°C 1분을 45회, final-extension 72°C 5분을 하였다. 9643.T4 증폭 PCR 산물은 Taqα I (65°C 3시간)으로 제한효소 처리하였다. 1.5~2% agarose gel에서 PCR 산물을 5 μl를 로딩하고 100 V 50~100분간 전기영동하여 EtBr로 염색한 후 UV transilluminator (MiniBIS pro, DNR Bio-Imaging Systems Ltd., Israel)로 유전자형을 판정하였다.
Table 2.
DNA markers and restriction enzymes used to detect R-genes (bacterial blight and rice stripe virus).
| Marker |
Resistance gene tagged |
Restriction enzyme | Forward primer (5’- 3’) Reverse primer (5’- 3’) | Reference |
| 9643.T4 | Xa3 | TaqαⅠ |
AGCCGAGCAATGATACCGACA ACAACTGGGATCGAACCGACA |
Jeung et al. (unpublished) |
| U1/I1 | Xa21 | - |
CGATCGGTATAACAGCAAAAC ATAGCAACTGATTGCTTGG | Wang et al., 1995 |
| Indel 7 | Stv-bi | - |
AAATTCCAATGCCCAAAACC TCCTCATGGAGCTCATCCAA | Kwon et al., 2012 |
ABLs21의 염색체단편 이입 분석
www.gramene.org에서 19,480개의 simple sequence repeat (SSR) 마커정보를 수집하였다(www.gramene.org/markers/ microsat, McCouch et al., 2002). ABLs21 유전체에 수여친 IRBB21의 염색체 단편 이입의 다형성을 동정하기 위해 19,480개 SSR 마커 중에서 평균 7.5 cM 간격으로 배치될 수 있게 12개의 염색체 분포 위치를 알고 있는 211개의 SSR 마커를 재선별하였다. 모본(반복친) 황금누리와 부본(수여친) IRBB21의 DNA를 211개의 SSR 마커로 PCR을 수행하였다. PCR (Bio-Rad, PTC-200 Thermocycler, Germany) 증폭 조건은 pre-denaturation 94°C 5분간 1회, denaturation 94°C 30초, annealing 60°C 30초, extension 72°C 1분을 35회, final-extension 72°C 5분을 하였다. 증폭 PCR 산물은 6~40% polyacrylamide gel에 4 μl를 로딩하고 100 V 130분간 전기영동하여 EtBr로 염색한 후 UV transilluminator (MiniBIS pro, DNR Bio-Imaging Systems Ltd., Israel)로 유전자형을 판정하였다. 다형성 판정기준은 ABLs21이 수여친과 같은 밴드를 보이면 수여친 염색체 단편 100%, 반복친과 같은 밴드를 보이면 수여친 염색체 단편 0% 및 반복친 염색체 단편 100%, 반복친, 수여친 밴드와 둘다 다른 밴드이거나 모두 같으면 다형성이 없는 것으로 판정하였다.
통계분석
본 연구에 사용된 모든 통계분석은 R (ver. 3.3.2)과 Excel (ver. 2016)를 사용하였으며 분산분석의 다중 평균간과 두 평균간의 유의성은 1%, 5% 수준으로 각각 Least Significant Difference (LSD), t-test를 수행하여 분석하였다. SSR 마커 사이의 염색체 단편 이입의 분포를 표현하기 위해 MapChart (ver. 2.2)를 이용하였다.
결과 및 고찰
Advanced backcross lines 21 계통 육성
벼 흰잎마름병(K1·K2·K3)과 줄무늬잎마름병에 강한 중만생종 고품질 품종인 황금누리를 모본(반복친)으로 하고 저항성 유전자 Xa21을 가진 IRBB21을 부본(수여친)으로 교잡하여 F1 HR28291 (황금누리/IRBB21)을 육성하였다(Fig. 1). F1을 황금누리와 여교배하고 BC1F1에서 K3a 레이스를 접종하여 저항성 반응을 가진 BC1F1 개체를 선발하였다. 이 과정을 2번 반복하여 저항성 반응을 가지며 외관 표현형이 우수한 BC3F1 20개체를 선발하였다. BC3F1에서 Xa21 유전자를 검출하는 U1/I1 마커를 사용하여 분자표지검정(Marker- assisted selection; MAS)도 함께 수행하였다. 저항성 반응을 나타내는 BC3F1 20개체에서 개체군당 60개체씩 총 1,200개체를 이앙하였고, 그 중 K3a 레이스(HB1009)에 저항성이며 출수기가 중만생종이고 이삭과 초형이 우수한 BC3F2 120개체를 선발하였다. BC3F2에서 987개체의 벼 흰잎마름병 저항성과 감수성 반응은 저항성 752개체, 감수성 235개체가 측정되었고 적합도 검정 결과 표현형 분리가 기대분리비 3 : 1에 일치함을 보였다(Table 3). 선발한 개체 중 자포니카 품종 선발을 위해 인디카의 특징인 장립형과 심복백이 있는 계통을 도태시키고 이삭, 초형, 간장, 수장, 분얼각도, 출수기 등이 모본(반복친)과 유사한 BC3F3 55개체를 전개하였다. 벼 흰잎마름병 K3a 레이스 접종과 반복친과 비슷한 형질 선발을 계속 실시하여 BC3F3 8계통에서 계통당 5개체씩 선발하여 40계통을 BC3F4로 전개하였다. BC3F4 계통에서 다시 이삭과 초형이 우수한 개체를 계통당 5개체씩 선발하여 BC3F5 50계통을 전개하였다. 또한 BC3F2~BC3F5에서는 생물검정과 동시에 잎도열병 밭못자리검정을 수행하여 도열병에 감수성인 개체는 도태시켰고 BC3F5에서는 줄무늬잎마름병 분자표지검정을 통해 저항성 유전자 Stv-bi의 보유 여부를 확인하였다. 최종적으로 BC3F6에서 BC3F6 5계통(ABL21-1, ABL21-2, ABL21-3, ABL21-4, ABL21-5)을 선발하였다(Fig. 2).
Table 3.
Segregation ratio of the resistance reaction in BC3F2 against bacterial blight K3a race, Xanthomonas oryzae pv. oryzae HB1009.
| Cross | No. of F2 lines | Expected ratio | χ2 | p-value | ||
| Resistance | Susceptible | Total | ||||
| Hwanggeumnuri*4/IRBB21 | 752 | 235 | 987 | 3 : 1 | 0.7460 | 0.3877 (05<p<0.9) |
ABLs21의 기타 병해충 저항성
벼 줄무늬잎마름병 저항성 검정 결과 ABLs21의 모본인 황금누리는 벼 줄무늬잎마름병에 저항성을 나타내며 저항성 유전자인 Stv-bi을 가지고 있었다. 이에 ABLs에 대해서도 BC3F5 세대에 저항성 유전자 분자표지 검정을 탐침 마커 Indel7으로 PCR 한 결과 ABLs21 모두 Stv-bi 유전자를 가지고 있는 것으로 확인됐다. 생물검정은 실시하지 못하였다(Fig. 3).
벼멸구 유묘 저항성 결과 ABLs21, 황금누리, IRBB21 모두 벼멸구에는 저항성이 없는 것으로 나타났다.
벼 흰잎마름병 저항성 유전자 집적효과
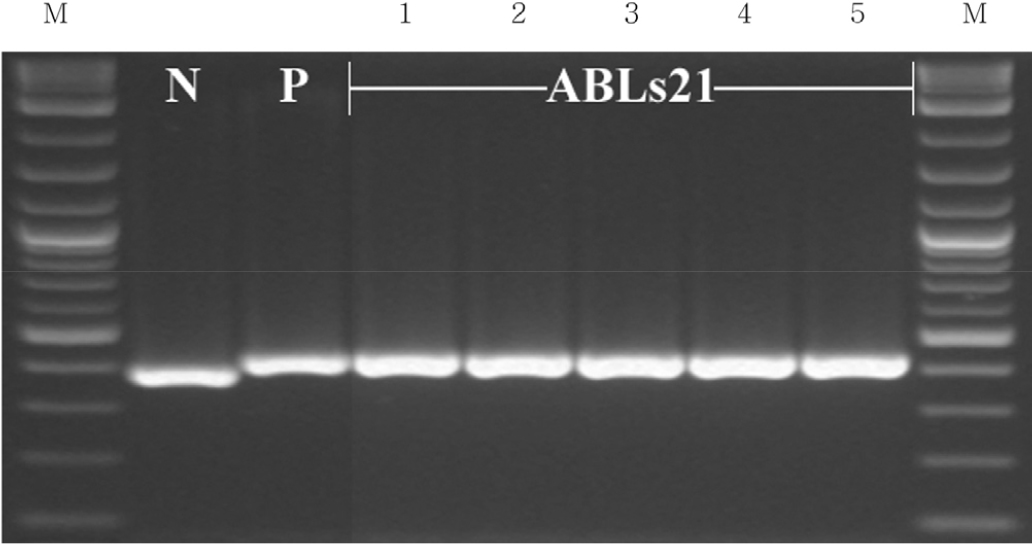
분자표지를 활용한 저항성 유전자 검정에서 황금누리는 Xa3 저항성 유전자 탐침 분자표지 9643.T4로 PCR 후 제한효소(Taqα I) 처리하여 350 bp에서 IRBB3와 똑같은 밴드로 증폭한 결과를 얻었다. IRBB21은 Xa21 저항성 유전자 탐침 분자마커 U1/I1으로 PCR 하여 저항성 유전자가 없는 남평과 차이나는 1,400 bp에서 증폭한 결과를 얻었다(Fig. 4).
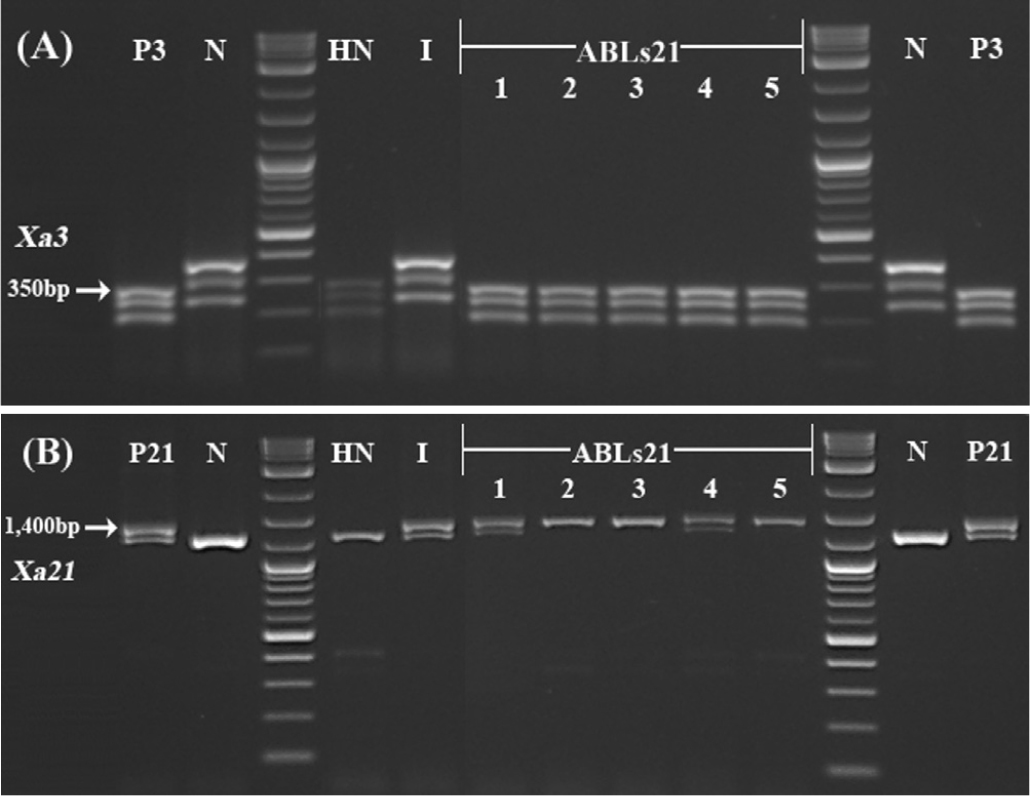
Fig. 4
Confirmation of bacterial blight resistance genes in recurrent/donor parents and ABLs21. Xa3 and Xa21 genes were amplified with primer 9643.T4 (Taqα I, A) and U1/I1 (B), respectively. P3: IRBB3, P21: IRBB21, N: Nampyeong, HN: Hwanggeumnuri, I: IRBB21, 1: ABL21-1, 2: ABL21-2, 3: ABL21-3, 4: ABL21-4, 5: ABL21-5.
모본으로 사용한 반복친 황금누리, 국제벼연구소에서 개발한 NILs IRBB3는 저항성 유전자 Xa3를 가지고 있으며 K1, K2, K3 레이스 접종에 병반길이 5 cm 미만의 저항성 반응을 보였지만 K3a, K4, K5에는 감수성 반응을 나타냈다. 반면, 부본으로 사용한 수여친 IRBB21은 K1에는 감수성 반응을 보였다. 감수성 비교품종인 남평은 저항성 유전자가 없는 품종으로 모든 레이스에서 감수성 반응을 보였지만 Xa3와 xa5 유전자를 가진 안백은 반대로 저항성 반응을 보였다. 본 연구에서 육성된 여교배 육종 계통 ABLs21은 검정한 K1·K2·K3·K3a·K4·K5 모든 레이스에서 저항성 반응을 나타냈다(Table 4).
Table 4.
Reaction patterns of recurrent/donor parents, ABLs21, and check varieties to Korean bacterial blight races (K1, K2, K3, K3a, K4, and K5).
| Variety | Gene | Bacterial blight race | |||||
| K1z) | K2 | K3 | K3a | K4 | K5 | ||
| Hwanggeumnuri | Xa3 | R | R | R | S | S | S |
| IRBB3 | Xa3 | R | R | R | S | S | S |
| IRBB21 | Xa21 | S | R | R | R | R | R |
| ABL21-1 | Xa3+Xa21 | R | R | R | R | R | R |
| ABL21-2 | Xa3+Xa21 | R | R | R | R | R | R |
| ABL21-3 | Xa3+Xa21 | R | R | R | R | R | R |
| ABL21-4 | Xa3+Xa21 | R | R | R | R | R | R |
| ABL21-5 | Xa3+Xa21 | R | R | R | R | R | R |
| Nampyeong | None | S | S | S | S | S | S |
| Anbaeg | Xa3+xa5 | R | R | R | R | R | R |
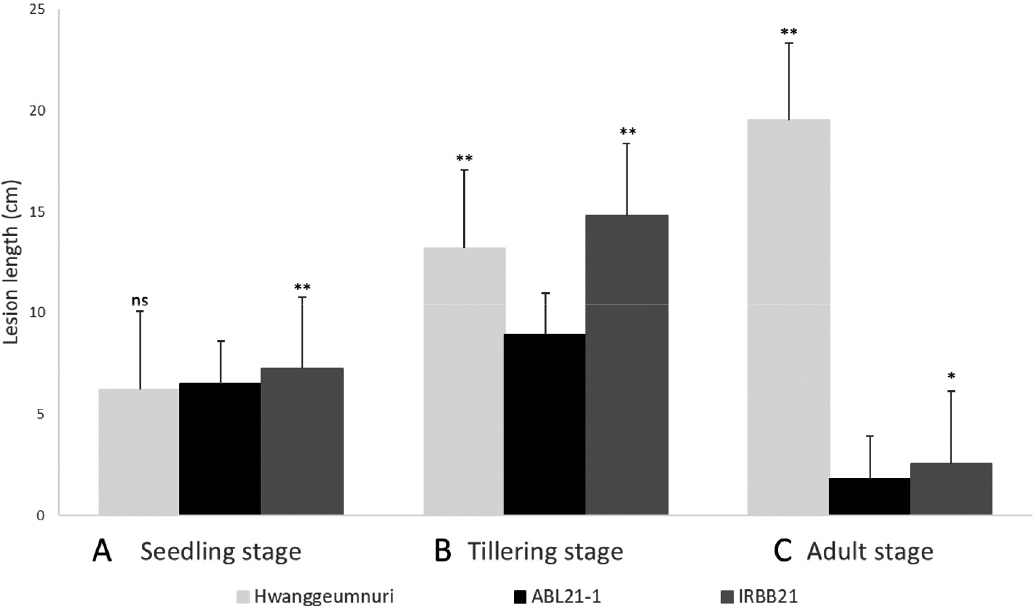
생육단계별 벼 흰잎마름병 K3a 레이스 저항성 반응을 보면 K3a 레이스에 침해 된다고 보고되어 있는 Xa3 유전자 보유 모본 황금누리는 파종 후 30~35일 사이 유묘단계에서 감수성 반응을 보였다. 반면 Xa21을 가진 IRBB21은 유묘단계에서는 7.2 cm로 감수성 반응을 보였고 후대 여교배 계통인 ABL21-1도 6.5 cm로 병반 길이가 약간 줄긴 했지만 감수성 반응을 나타냈다. 분산분석 결과 ABL21-1은 황금누리, IRBB21과 서로 다른 그룹을 형성해 유의차는 인정되었다. T-test 결과 ABL21-1은 IRBB21과 유의차가 인정되었다. 파종 후 60~65일 사이 분얼단계에서도 유묘단계와 마찬가지로 황금누리, IRBB21은 병반길이 5 cm 이상의 감수성 반응을 나타냈다. 하지만 ABL21-1은 8.9 cm로 모부본인 황금누리(13.2 cm), IRBB21 (14.8) 보다는 짧은 병반길이를 나타내며 중도저항성 반응을 보였다. 분산분석 결과 ABL21-1, 황금누리, IRBB21은 서로 간 유의차가 인정되었다. T-test 결과 ABL21-1과 모부본 간의 유의차는 인정되었다. 파종 후 100~105일 사이 성체 단계(최대분얼기)에 접종하였을 때 유묘·분얼단계와는 다르게 IRBB21과 ABL21-1은 병반 길이 2.5 cm, 1.8 cm로 저항성 반응을 나타냈다. 모본 황금누리는 19.5 cm로 감수성 반응을 계속해서 보였다. 분산분석 결과 ABL21-1은 부본 IRBB21과 같은 그룹을 형성해 유의차가 인정되었다. T-test 결과 ABL21-1과 황금누리, IRBB21 간에는 유의차가 인정되었다(Table 5, Fig. 5).
Table 5.
Comparison of resistance reactions between recurrent/ donor parents and ABLs21 at various growth stages (seedling stage, A; tillering stage, B; adult stage, C). **, *, and ns means significantly different at p=0.05, p=0.01, and no significant by t-test, respectively.
| Var/lines | R-gene | Seedling stagez) | Tillering stage | Adult stage | |||||
| LLy) | R/Sx) | LL | R/S | LL | R/S | ||||
| Hwanggeumnuri | Xa3 | 6.2 a | S | 13.2 a | S | 19.5 a | S | ||
| IRBB21 | Xa21 | 7.2 b | S | 14.8 b | S | 2.5 b | R | ||
| ABL21-1 | Xa3+Xa21 | 6.5 c | S | 8.9 c | MRw) | 1.8 b | R | ||
| LSD0.05 | 0.240 | 1.274 | 0.925 | ||||||
| C.V. (%) | 1.815 | 5.185 | 5.829 | ||||||
| Nampyeong | None | 7.2 | S | 13.8 | S | 24.2 | S | ||
| IRBB3 | Xa3 | 6.9 | S | 15.2 | S | 22.5 | S | ||
| Anbaeg | Xa3+xa5 | 1.6 | R | 1.4 | R | 1.7 | R | ||
Xa3, Xa21 유전자는 성장시기에 따라 저항성 반응이 다른 유전자로 알려져 있다. Horino & Ezuka (1973)은 Xa3 유전자를 가진 Wase Aikoku 3는 7~8엽기 이후에 저항성을 완전히 발현한다고 하였고 이를 성체저항성이라고 처음 제안하였다. Mazzola et al. (1993)은 IRBB21은 성체저항성을 가지며 유묘기에 뚜렷한 저항성을 발견하지 못했다고 하였다. 하지만 Zhang & Mew (1985, 1989)는 성체저항성이 모든 레이스와 품종에 적용되는 것이라고 볼 수 없다고 하였다. 본 실험에서도 IRBB21은 유묘기와 분얼기에 감수성 반응을 보였고 성체기인 100일 이후에는 저항성 반응을 보였다. 하지만 ABL21-1은 유묘기에 감수성 반응이지만 분얼기에는 중도저항성을 보여 다른 반응을 보였다. 이 결과로 레이스와 품종간 상호작용에 따라 저항성 유전자의 발현 양상이 달라질 수 있음을 알 수 있었다. 또한, Zhang et al. (1984)은 성체저항성은 파종 후 55일(9엽기)과 68일(11엽기) 사이에 발현한다고 하였는데 본 실험에서 분얼기를 파종 후 60~65일로 설정 한 만큼 IRBB21과 ABL21-1 간의 저항성 발현 시기가 유전적 배경이 다른 차이에서 오는 것인지 IRBB21과 다르게 ABL21-1이 가진 Xa3 유전자의 상가적 반응인지에 대한 연구는 더 진행되어야 할 것으로 생각된다.
K3a 레이스의 18개 벼 흰잎마름병 균주에 대한 ABL21-1의 저항성 반응 검정결과 황금누리에서도 15 cm 이상의 병반 길이를 보이며 18개 모든 균주에 대해 감수성 반응을 나타냈다. 부본인 IRBB21과 ABL21-1은 18개 균주에 대해 강한 저항성 반응을 보였다. ABL21-1도 부본인 IRBB21의 형질을 이어 받은 것으로 나타났다. 모본인 황금누리의 병반길이 평균은 16.67 cm로 비교품종인 남평의 19.76 cm보다 약 3 cm 짧았으며 표준편차는 황금누리에서 더 크게 나타났다. ABL21-1의 병반길이는 1.84 cm로 부본인 IRBB21의 2.05 cm, 비교품종 안백의 2.18 cm 보다 짧았다. ABL21-1의 병반길이의 범위는 1.1~2.3 cm였고 IRBB21은 1.7~2.6 cm로 IRBB21의 표준편차가 높게 나왔다. HB4040 균주는 ABL21-1에서 최소병반길이를 보였지만 IRBB21에서는 최대병반길이를 나타냈다. ABL21-1에 최대병반길이를 나타낸 HB4024 균주는 IRBB21에서 2 cm 이상의 병반길이를 보였지만 최대병반길이를 보이진 않았다. ABL21-1과 모부본에서도 특정 균주가 검정 계통 간 동일한 침해 경향을 보이진 않았다. 병반길이 평균값의 분산분석 결과 감수성인 남평과 황금누리는 유의차가 인정되었으나 저항성인 ABL21-1, IRBB21은 유의차가 인정되지 않았다(Table 6).
Table 6.
Resistance reaction of recurrent/donor parents, advanced backcross line 21-1 with different genotypes against 18 Korean Xanthomonas oryzae pv. oryzae isolates.
| Isolatez) | Nampyeong | Hwang. | Anbaeg | ABL21-1 | IRBB21 | ||||
| no r-gene | Xa3 | Xa3+xa5 | X3+Xa21 | Xa21 | |||||
| HB1009 | 24.2 (S)y) | 19.5 (S) | 1.7 (R) | 1.8 (R) | 2.5 (R) | ||||
| HB2024 | 21.3 (S) | 15.5 (S) | 2.5 (R) | 2.2 (R) | 2.4 (R) | ||||
| HB2038 | 19.8 (S) | 16.8 (S) | 2.4 (R) | 1.9 (R) | 1.9 (R) | ||||
| HB3034 | 17.5 (S) | 17.2 (S) | 1.5 (R) | 1.8 (R) | 1.8 (R) | ||||
| HB3055 | 18.3 (S) | 12.9 (S) | 2.7 (R) | 2.2 (R) | 2.0 (R) | ||||
| HB4024 | 20.4 (S) | 18.8 (S) | 2.6 (R) | 2.3 (R) | 2.1 (R) | ||||
| HB4032 | 22.8 (S) | 15.4 (S) | 2.7 (R) | 2.0 (R) | 2.5 (R) | ||||
| HB4040 | 20.1 (S) | 13.8 (S) | 2.0 (R) | 1.1 (R) | 2.6 (R) | ||||
| HB4052 | 18.2 (S) | 18.9 (S) | 1.9 (R) | 2.1 (R) | 2.2 (R) | ||||
| HB4079 | 21.2 (S) | 17.7 (S) | 1.5 (R) | 2.2 (R) | 1.8 (R) | ||||
| HB4084 | 22.3 (S) | 20.1 (S) | 2.7 (R) | 2.1 (R) | 1.7 (R) | ||||
| HB4087 | 19.8 (S) | 21.5 (S) | 3.0 (R) | 1.3 (R) | 2.0 (R) | ||||
| HB5004 | 19.2 (S) | 15.5 (S) | 2.0 (R) | 1.7 (R) | 2.1 (R) | ||||
| HB5027 | 17.7 (S) | 16.7 (S) | 2.9 (R) | 1.2 (R) | 2.2 (R) | ||||
| HB5029 | 16.5 (S) | 18.5 (S) | 1.1 (R) | 1.8 (R) | 1.9 (R) | ||||
| HB6142 | 19.4 (S) | 13.1 (S) | 3.2 (R) | 1.7 (R) | 1.7 (R) | ||||
| HB6151 | 17.1 (S) | 11.5 (S) | 1.5 (R) | 1.9 (R) | 1.8 (R) | ||||
| HB6156 | 19.9 (S) | 16.7 (S) | 1.7 (R) | 2.0 (R) | 1.9 (R) | ||||
| LSD0.05 | 2.48 | 1.88 | 0.43 | 0.59 | 0.72 | ||||
| C.V. (%) | 7.58 | 6.79 | 11.83 | 19.29 | 21.26 | ||||
| Mean±SD | 19.8 ± 1.25 ax) | 16.7 ± 1.88 b | 2.2 ± 0.42 c | 1.84 ± 0.41 c | 2.1 ± 0.46 c | ||||
| LSD0.05 | 0.695 | ||||||||
| C.V. (%) | 21.452 | ||||||||
Cao et al. (2007)은 Xa3는 인디카 배경보다 자포니카 배경에서 발현이 촉진되고 증대되어 저항성 범위와 정도가 강화된다고 하였고 Park (2016)은 Xa3 유전자를 가진 수원345호 NIL은 K3a 레이스 균주에 10 cm 이상의 병반길이를 나타내는 감수성 이지만 저항성 유전자가 없는 수원345호 보다는 병반길이가 약 1 cm 짧다고 하였다. 본 연구에서도 황금누리는 남평보다 병반길이가 2~3 cm 짧은 결과를 보이며 분산분석 결과도 같은 그룹으로 형성되었다. Suh et al. (2009)은 K3a 레이스 18개 균주 접종 시 Xa4 단일 유전자는 8개 균주에, xa5+Xa21 조합은 14개 균주에, Xa4+ xa5+Xa21 조합은 18개 균주에 저항성을 나타낸다고 하였으며 Park (2016)은 Xa3+Xa21, xa5+Xa21 조합보다는 세 개의 유전자가 집적된 Xa3+xa5+Xa21 조합이 더 강한 저항성 반응을 나타낸다고 하였다. 본 연구의 저항성 그룹에서 병반길이는 짧은 순서로 ABL21-1 (Xa3+Xa21, 1.84), IRBB21 (Xa21, 2.05), 안백(Xa3+xa5, 2.18) 이었다. 하지만 두 개의 유전자를 가진 안백 보다는 단일 유전자의 IRBB21의 병반길이가 더 짧았으며 표준편차도 작은 이유는 안백의 Xa3+ xa5 집적효과보다 Xa21 유전자가 가진 저항성 능력이 보다 높았던 것으로 추측되며 ABL21-1은 Xa21+Xa3 유전자 집적이 상호보완적인 저항성을 나타내 전체적인 저항성 수준을 끌어올린 것으로 생각된다(Suh et al., 2013).
ABLs21의 모부본 염색체단편 이입 분석
모본(반복친) 황금누리와 벼 흰잎마름병에 강한 저항성을 가진 부본(수여친) IRBB21을 교배하여 육성한 ABLs21에 대하여 부본(수여친) IRBB21의 염색체단편의 이입 정도를 알기 위해 유전적 배경 분석을 수행하였다. 총 211개의 SSR 분자표지를 선발하여 벼 전체 게놈의 1504.6 cM을 평균 간격은 7.5 cM으로 커버할 수 있는 물리지도를 만들었다. 211개 SSR 분자표지를 PCR 한 후 다형성 분석 결과 135개의 SSR 분자표지가 다형성을 나타냈으며 비율은 63.2% 였다. 12개 염색체 중 염색체 2번이 50%로 분자표지 다형성이 가장 낮았으며 염색체 7번이 84.2%로 가장 높은 분자표지 다형성을 보였다. ABL21-1은 염색체 9번에서 16.8 cM으로 부본(수여친) IRBB21의 염색체단편 이입길이가 가장 길었고 염색체 1번은 5.2 cM으로 가장 짧았다. ABL21-2는 최대·최소가 염색체 7번 24.1 cM, 염색체 6번 4.6 cM이었고 ABL21-3은 염색체 12번 14.4 cM, 염색체 4번 4.5 cM, ABL21-4는 염색체 1번 16.6 cM, 염색체 2번 6.4 cM, ABL21-5는 염색체 2번 31.4 cM, 염색체 4번 4.6 cM이었다. ABLs21 계통 중 이입된 염색체단편이 가장 긴 계통은 120.6 cM의 ABL21-5이었고 가장 짧은 계통은 61.1 cM의 ABL21-3으로 ABLs21 간에 편차가 컸다. ABLs21의 12개 염색체 중 가장 많은 염색체단편이 이입된 것은 염색체 7번으로 총 76.8 cM 이었다. 염색체 3번, 8번, 10번은 이입된 염색체단편이 하나도 없었으며 염색체 1번 7번, 11번, 12번은 전 계통에서 염색체단편 이입이 일어났다. 염색체 11번과 12번은 모든 ABLs21의 동일한 부위에 염색체단편이 들어갔으며 특히 염색체 11번의 RM5997 부위는 벼 흰잎마름병 저항성 유전자 Xa21 유전자 주변으로 추정되는 곳으로(Wang et al., 1995) 분자표지 다형성을 보여 그 부위가 염색체단편이 이입 된 것을 확인하였고 Xa3 유전자 부위로 추정되는 RM7170 부위는 다형성이 나타나지 않았다(Table 7, Table 8, Fig. 6, Fig. 7).
Table 7.
Simple sequence repeat markers with polymorphism between recurrent parents and substituted chromosome segments from donor parent in ABLs21.
| CNz) | TMy) (ea) | PMIx) (ea) | POMIw) (%) | MIv) (cM) | CLu) (cM) |
| 1 | 31 | 20 | 64.5 | 6.0 | 181.8 |
| 2 | 22 | 11 | 50.0 | 7.1 | 154.1 |
| 3 | 22 | 17 | 77.3 | 7.7 | 166.4 |
| 4 | 18 | 9 | 50.0 | 7.4 | 129.6 |
| 5 | 19 | 13 | 68.4 | 6.4 | 122.0 |
| 6 | 21 | 13 | 61.9 | 6.1 | 124.4 |
| 7 | 19 | 16 | 84.2 | 6.3 | 118.3 |
| 8 | 13 | 7 | 53.8 | 8.2 | 124.6 |
| 9 | 11 | 6 | 54.5 | 9.0 | 93.1 |
| 10 | 12 | 8 | 66.7 | 7.6 | 83.8 |
| 11 | 14 | 10 | 71.4 | 8.5 | 115.1 |
| 12 | 9 | 5 | 55.6 | 10.2 | 91.4 |
| Total (Average) | 211 | 135 | (63.2) | (7.5) | 1,504.6 |
Table 8.
Length of substituted segments of donor (IRBB21) of ABLs21.
| Chr. no.z) | ABL21-1 | ABL21-2 | ABL21-3 | ABL21-4 | ABL21-5 | Total | ||||||||||
| LSSy) (cM) | CSDPx) (%) | LSS (cM) | CSDP (%) | LSS (cM) | CSDP (%) | LSS (cM) | CSDP (%) | LSS (cM) | CSDP (%) | LSS (cM) | ||||||
| 1 | 5.2 | 2.8 | 5.2 | 2.8 | 9.0 | 4.9 | 16.6 | 9.1 | 5.4 | 3.0 | 41.4 | |||||
| 2 | 0 | 0 | 13.7 | 8.9 | 6.4 | 4.1 | 6.4 | 4.1 | 31.4 | 20.3 | 57.9 | |||||
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||
| 4 | 9.0 | 6.9 | 0 | 0 | 4.5 | 3.4 | 9.0 | 6.9 | 4.6 | 3.5 | 27.1 | |||||
| 5 | 6.6 | 5.4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6.6 | |||||
| 6 | 0 | 0 | 4.6 | 3.7 | 4.6 | 3.7 | 10.6 | 8.5 | 5.3 | 4.3 | 25.1 | |||||
| 7 | 11.0 | 9.3 | 24.1 | 20.3 | 11.0 | 9.3 | 11.0 | 9.3 | 19.7 | 16.7 | 76.8 | |||||
| 8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||
| 9 | 16.8 | 18.0 | 22.1 | 23.7 | 0 | 0 | 0 | 0 | 28.6 | 30.7 | 67.5 | |||||
| 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||
| 11 | 11.2 | 9.7 | 11.2 | 9.7 | 11.2 | 9.7 | 11.2 | 9.7 | 11.2 | 9.7 | 56.0 | |||||
| 12 | 14.4 | 15.8 | 14.4 | 15.8 | 14.4 | 15.8 | 14.4 | 15.8 | 14.4 | 15.8 | 72.0 | |||||
| Total | 74.2 | 4.9 | 95.3 | 6.3 | 61.1 | 4.1 | 79.2 | 5.3 | 120.6 | 8.0 | 430.4 | |||||
분자표지 기술의 발달은 저항성 유전자의 탐침 뿐만 아니라 유전자 매핑, QTL 분석 등에 유용하게 사용되고 있다(Huang et al., 1997; McCouch et al., 2002). 기술 활용 중 염색체단편치환 계통 등을 활용한 유전분석이 수행되고 있으며 주로 야생벼와의 교배 계통이 사용된다(Yano et al., 2000). 본 연구에서 육성된 ABLs21은 자포니카/인디카 원연교배로 반복친 자포니카 유전적 배경에 인디카 수여친의 염색체단편이 이입된 계통으로 유전분석의 기초자료로 활용하기 위해 211개의 SSR 분자표지(McCouch et al., 2002; IRMI, 2003)를 이용하여 ABLs21의 부본(수여친) IRBB21의 염색체단편의 이입 정도를 알아보았다. 여교배 육종법으로 육성된 ABLs21은 반복친의 유전적 배경이 여교배 횟수로 볼 때 87.5% 이상으로 보고 수여친의 염색체단편 이입은 12.5% 이하로 추정하였는데 실험결과 수여친 염색체단편이 확실한 것은 ABLs21에서 4.1~8.0% 범위를 나타냄을 알 수 있었다. ABLs21의 양적형질이 관여하는 주요 농업적 형질의 모부본과의 차이는 여교배 과정에서 반복친의 유전적 배경의 회복이라 보이고 질적형질이 관여하는 벼 흰잎마름병 저항성의 차이는 이입된 수여친 염색체단편의 영향으로 생각된다. 이입된 염색체단편의 위치에 따른 모부본과의 농업적형질 비교분석은 매우 중요한 일이며 많은 연구에서 수행되었다. Kang et al. (2011)은 비교분석을 통해 염색체 2번 장완 RM106과 RM263 사이에 장폭비와 입형, RM250에 천립중, 염색체 3번 단완 RM60에 수량과 수당립수, 염색체 6번 단완에 수량과 출수기와 관련된 QTL이 있다고 보고하였다. 하지만 기존 연구와 본 실험에서 사용한 SSR 마커세트가 상이하고 재배환경이 다르며 각각 5개의 고정된 계통의 농업적 특성을 조사한 것이기에 표현형 분산에 편의가 발생할 수 있어 ABLs21의 염색체단편이입 분석을 가지고 환경변이의 영향이 큰 QTL의 직접적인 비교는 어려울 것으로 판단하였다. 이들 ABLs의 농업형질과 연관된 QTL에 대한 해석은 후대계통 F2 분석이 수반된 실험을 통해 이뤄져야 할 것이라 생각하며 본 실험에서는 전체 게놈에 단편이 들어간 전체적인 그림을 그리는 단계까지 수행 하였다. ABLs21에서 Xa21 유전자 부위라 추측되는 RM5997 부위는 수여친 IRBB21에서 온 것으로 나타난 반면 Xa3 유전자 추측 부위인 RM7170 영역은 다형성이 나타나지 않았다. 다형성이 나타나지 않은 부위는 반복친과 수여친 중 어느 쪽인지 명확하지 않아 SSR 마커를 확대하여 매핑 할 필요가 있을 것으로 생각된다. ABLs21에서는 염색체 11번의 염색체단편 이입이 많지 않았는데 여교배 횟수와 단일저항성 유전자 선발에 따른 육종 선발강도의 차이로 생각되지만 보다 면밀한 검토가 필요할 것으로 판단된다.
벼 품종 개량의 목적 중 수량성 향상이 항상 제일 큰 목표였다면 수량성에 큰 영향을 주는 병해충에 강한 품종을 육성하는 것 또한 매우 중요한 일로 생각되어 왔다. 벼의 가장 큰 병 중 하나인 벼 흰잎마름병은 저항성 품종보다 감수성 품종에서 더욱 빠르게 증식하며 보다 많은 피해를 준다. 따라서 병 전파 지연, 병원균 집단의 안정화 및 단일 저항성 유전자 품종의 지속성을 위해 다양한 저항성 유전자를 가진 품종을 육성하고 재배하여야 할 것으로 보인다. 이에 맞춰 본 연구는 저항성 유전자 확대를 위해 저항성 유전자가 다양한 인디카와의 원연교배를 수행하고 전통육종과 분자육종을 활용하여 우리나라에 적합한 자포니카 품종을 개발하는데 노력하였다.
적 요
본 연구는 유전자의 확대와 집적을 통해 벼 흰잎마름병균 K3a에 대응하는 저항성 계통을 육성하였고 육성계통에 대한 육종과정, 병 저항성반응을 분석하여 저항성 계통의 기초자료와 재배 효과를 제공하여 우수한 벼 흰잎마름병 저항성 품종 개발에 활용하고자 실험을 수행하였다. 벼 흰잎마름병 저항성 Xa3 유전자를 가지고 있는 중만생 자포니카 품종 황금누리를 반복친으로, Xa21 유전자를 가진 중만생 인디카 근동질유전자계통 IRBB21을 수여친으로 인공교배 후 3번 여교배하여 ABLs21을 얻었다. 생물검정과 분자표지검정을 활용하여 저항성 유전자 Xa3, Xa21이 집적을 확인하였다. ABLs21이 보유한 저항성 유전자는 분자표지 9643.T4 (Xa3), U1/I1 (Xa21)로 PCR 한 결과 모두 증폭되어 저항성 유전자를 가지는 것으로 확인되었다. ABLs21과 모부본의 벼 흰잎마름병 레이스에 대한 저항성 반응은 황금누리, IRBB3가 K1, K2, K3 레이스에 저항성 반응을 보였지만 K3a, K4, K5에는 감수성 반응을 나타냈다. IRBB21은 K1에 감수성 반응이었고 K2~K5에는 저항성 반응이었다. K3a 레이스 균주 접종 시 유묘단계에서 황금누리, IRBB21, ABL21-1, 분얼단계에서 황금누리, IRBB21, 성체단계에서 황금누리가 감수성 반응이었다. ABL21-1은 분얼단계에서 중도저항성을, 성체단계에서 저항성 반응을 나타냈다. K3a 레이스 18개 균주 접종 결과 ABL21-1은 각각의 수여친보다 병반길이와 표준편차가 작아 안정적인 저항성을 보여주었다. 18개 균주 각각의 반복간 병반길이의 유의차는 없어 균주의 병원성은 안정적이었으며 군집분석 결과 HB4032 균주의 병원력이 가장 큰 것으로 나타났다. ABLs21의 분자표지 다형성은 63.2%이며 평균 86.1 cM의 염색체단편이 이입되었다. ABLs21의 Xa21 유전자 부위로 추정되는 곳에 수여친의 염색체단편 이입이 일어났다.