서 론
재료 및 방법
시험재료 및 수분스트레스 처리
억새의 생육특성 조사
억새의 영양분 분석방법
통계분석
결과 및 고찰
수분스트레스 처리 후 억새 2종의 형태적 특성 변화
수분스트레스 처리 후 억새 2종의 양분함량 변화
적 요
서 론
억새는 C4 광합성 회로를 갖고 있으며, 일반적으로 지하경으로 번식하는 영년생 식물이다(Jensen et al., 2017). 이러한 억새속은 전세계적으로 17종이 존재한다고 알려져 있으며, 바이오에너지용으로 중요한 종은 2배체로 알려진 참억새(Miscanthus sinensis, 2n=2x=38)와 4배체인 물억새(Miscanthus sacchariflorus, 2n=4x=76), 유럽, 북아메리카 등에서 가장 많이 재배되고 있는 이질3배체(Miscanthus × giganteus, 3x=57)이다. 이 중 이질3배체는 물억새와 참억새의 자연교잡의 결과이다(Moon et al., 2010; Park et al., 2009; Song et al., 2018; Rayburn et al., 2009). 국내에서는 거대1호를 많이 연구하고 있으며, 거대1호는 농촌진흥청에서 수집한 유전자원을 대상으로 우수한 형질을 갖는 자원을 선발한 억새로 기존 물억새보다 초장이 크고 줄기가 굵어 바이오매스량이 많은 반면 출수율이 낮다(An et al., 2013). 억새 종들의 자생지 환경은 종별로 다르다. 참억새는 환경 적응성이 매우 강하며 주로 마른땅에 자생하지만 습해에 약한 단점이 있는 반면, 물억새는 강변, 호수 주변 등 습지 조건에서 자생한다(Kim et al., 2004; Moon et al., 2010).
억새의 개화, 출수 등 생식생장에 관한 연구는 다른 식물들과 다르게 비교적 미비한 실정이다. 참억새는 일장에 영향을 받지 않는 중성식물로 알려져 있으며, 물억새는 유전자원별 개화가 균일하지 않으나 단일조건에 개화하는 단일식물로 보고되고 있다(Deuter, 2000; Jensen et al., 2011a). 억새의 화아분화는 12~14시간의 광주기에서 시작되며, 광주기를 15시간 이상으로 증가시켰을 시 출수가 지연되었으며 바이오매스량은 52%가 증가하였다(Jensen et al., 2012). 또한 수분환경 중 건조 조건에서도 참억새, 물억새 등 억새의 출수가 지연된다고 보고되었다(Jensen et al., 2011b). 또한 최근 연구 결과에서 물억새는 전체 개체가 출수하기 전에 연중 생육을 종료하여 유전자원별로 노화시기에 따라 출수율이 다양하였으며, 이질3배체 억새나 참억새에 비해 재배지역 별로 출수하는 유전자원의 수가 다르게 나타나 생육 환경에 따라 출수율 변이가 심하다고 보고되었다(Nunn et al., 2017).
작물에서 수분 스트레스는 생육에 직접적인 영향을 주는 비생물학적 스트레스이다. 건조 조건하에서 작물은 증산을 감소시키기 위해 잎말림, 탈리를 촉진하며 뿌리의 신장을 촉진하여 수분 공급을 증가시키고자 한다(Bak et al., 2017; Taiz&Zeiger, 2010). 반면 침수 조건하에서 작물은 토양 내 산소 부족으로 산소결핍과 저산소상태에 놓이게 되므로, 부정근을 발생시키거나 증산을 억제하는 전략으로 산소결핍 상태를 회피하고자 한다(Seo et al., 2017; Taiz&Zeiger, 2010).
수분 스트레스 조건하에서 억새의 생육 반응 연구는 주로 건조조건 하에서 수행되었다. 가뭄조건하에서 물억새는 지상부의 바이오매스량을 증진시키고, 뿌리의 생장을 촉진시켰으며, 잎의 갈변화, 탈리를 촉진시키는 노화를 통해 건조스트레스를 회피하고자 하였다(Clifton-Brown&Lewandowski, 2000; Robson et al., 2012). 침수조건하에서 억새의 경우, 지하경은 피해를 거의 입지 않았으며 증산효율, 지상부 바이오매스량 등 생육의 전반적인 면에서 대조구와 차이를 보이지 않아 침수조건에 강한 내성을 갖는다고 보고되었다(Decruyenaere&Holt, 2005; Mann et al., 2013).
국내에서 억새는 타 밭작물들과의 경합을 피하기 위해 수변구역, 척박지 등 유휴지에서 주로 재배되고 있다. 또한 억새는 관광자원으로 이용하여 지역축제에 활용되기 때문에 경관용으로서 가치를 위해 출수 및 개화 또한 국내 억새 연구의 중요한 요인이 될 수 있다. 따라서 본 연구는 억새의 토양 수분 활용이 극단적인 유휴지 재배 여부를 판단하기 위해 물억새와 거대1호에서 장기간의 건조와 침수 조건하에서 출수 및 생육변화에 미치는 영향을 비교 분석하였다.
재료 및 방법
시험재료 및 수분스트레스 처리
본 시험은 2017년 전남 무안의 국립식량과학원 바이오에너지작물연구소 내에서 수행되었다. 시험에 사용된 억새 품종은 국립식량과학원에서 수집한 일반적인 물억새(M. sacchariflorus)와 국립식량과학원에서 육성한 물억새의 일종인 ‘거대1호(M. sacchariflorus cv. Geodae)’였다. 두 종 억새의 지하경을 이용하여 3월 15일 50공 트레이에 육묘를 제작하였으며, 4월 18일 시험 포트(높이 50 cm, 지름 45 cm)로 동일한 크기의 억새 육묘 3개씩을 이식하였다.
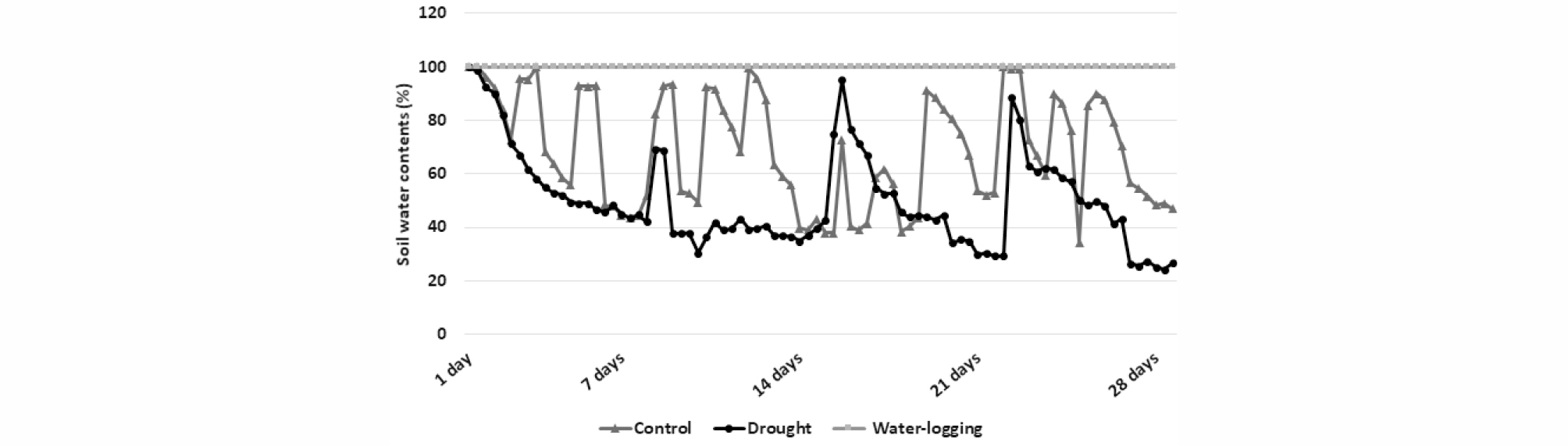
수분스트레스는 억새의 생식생장기가 시작되는 7월 14일 처리하였다(Fig. 1). 대조구는 주당 3회 관수를 실시하였으며, 가뭄 처리구는 대조구에 비해 관수량을 1/3 (1회 관수/주)으로 감소시켰다. 침수 처리구는 포트 전체를 물에 잠기게 하여 토양 수분을 100%로 유지하였다. 수분스트레스 처리는 억새가 출수하는 11월초까지 4개월간 지속하였다. 수분스트레스로 인한 억새 포트의 토양 수분 변화는 토양수분측정기(PlantCare Mini-Logger, Echo korea instruments Co.,LTD, Korea)를 사용하여 측정하였다(Fig. 2).
억새의 생육특성 조사
수분스트레스로 인한 억새 생육 변화를 알기 위해, 7월 초 두 종의 억새 포트의 초장, 경태, 마디수를 조사하여 생육량을 확인하였으며, 처리 전 이들 간의 생육량을 통계적으로 유의성을 보이지 않았다(not shown). 이후 수분스트레스 처리 4개월 후 11월 13일 초장, 경태, 마디 수, 출수율인 생육 특성을 조사를 실시하였다. 초장은 지면에서 이삭 및 가장 긴 잎 끝까지의 길이를 측정하였으며, 경태는 밑에서 두 번째 마디 중간의 두께, 마디 수는 지면에서 이삭목까지의 마디수를 측정하였다. 출수율은 포트 내의 모든 억새 중 출수한 개체의 비율을 계산하였다.
억새의 영양분 분석방법
수분스트레스로 인한 억새의 영양분 변화를 확인하기 위해, 생육특성 조사와 동일한 시기의 억새의 지상부를 채취하여 60°C에서 72시간 건조 후 분쇄하여 사용하였다. 광합성에 의해 생성된 sucrose 함량 변화를 확인하기 위한 유리당 함량은 분쇄된 건조 시료 1 g을 50% ACN으로 추출하여 HPLC (Agilent, DE/1260)으로 분석하였다. 분석 컬럼은 Zorbax Carbohydrate 4.6×250 mm, 5 µm (Agilent)을 이용하였으며, 이동상으로는 75% ACN을 사용하여 25분간 분석하였다. 무기성분 중 전질소는 분쇄한 건조 시료 250 mg을 CN분석기(Vario Max Cube elementar, Hanau, Germany)를 이용하여 조사하였다. 나머지 무기성분 분석은 농촌진흥청의 종합검정실 분석 매뉴얼(2013)에 따라 분석하였다. 억새 건조 시료 0.5g을 50% 과염소산과 농황산을 사용하여 분해하였다. 분해된 액체 시료에 Vanadate법을 이용하여 인산(P2O5, %)을 분석하였으며, 칼륨(K, g/kg), 칼슘(Ca, g/kg), 마그네슘(Mg, g/kg) 함량은 유도결합플라즈마 분광계(ICP-OES, Varian, USA)를 이용하여 측정하였다.
통계분석
통계분석은 R-studio version 1.1.442를 사용하여 수행되었으며, 조사 표본의 평균에 대한 ANOVA 분석 후, Tukey 사후검정을 실시하였다.
결과 및 고찰
수분스트레스 처리 후 억새 2종의 형태적 특성 변화
수분스트레스 처리에 따른 억새 포트의 토양 수분 함량은 관수 조건에 따라 변화하였다(Fig. 2). 대조구의 경우 관수 횟수와 동일하게 토양 수분은 100%까지 증가하는 횟수가 주당 3회였으며, 건조구에서는 주당 1회였고 이후 수분함량이 24.3%까지 감소하기도 하였다. 침수구에서는 99.9%의 수분함량이 보였다.
수분스트레스 처리 4주 후 억새 2종의 형태적 특성을 비교한 결과, 물억새에서는 초장, 경태, 마디수에서 모두 처리간 차이를 보이지 않았다(Fig. 3). 반면 거대 1호에서는 침수처리에 의해 초장이 256.6 cm로 증가하였으나, 건조구와 대조구의 초장 간의 통계적 유의성은 관찰되지 않았다(Fig. 3a). 또한 거대1호의 침수구에서는 마디수가 16.8개로 대조구 14.8개, 건조구 15.1개에 비해 더 많았다(Fig. 3c). 억새는 유전자원에 따라 다양한 초장을 가지며, 생식생장의 시작인 유수형성 시기 또한 한 달 이상 차이가 났으나, 유수형성시기에 억새의 마디수는 동일하게 9~10로 보고되었으며, 이러한 결과를 통해 억새의 마디수로 유수형성기를 비파괴적으로 예측할 수 있는 방법이라고 보고되었다(Yu, 2015). 우리의 실험에서도 대조구 및 건조구에 비해 침수구에서 마디수가 많은 결과를 보여, 이를 바탕으로 침수구에서 생식생장이 더 이루어졌다고 추측하였다.
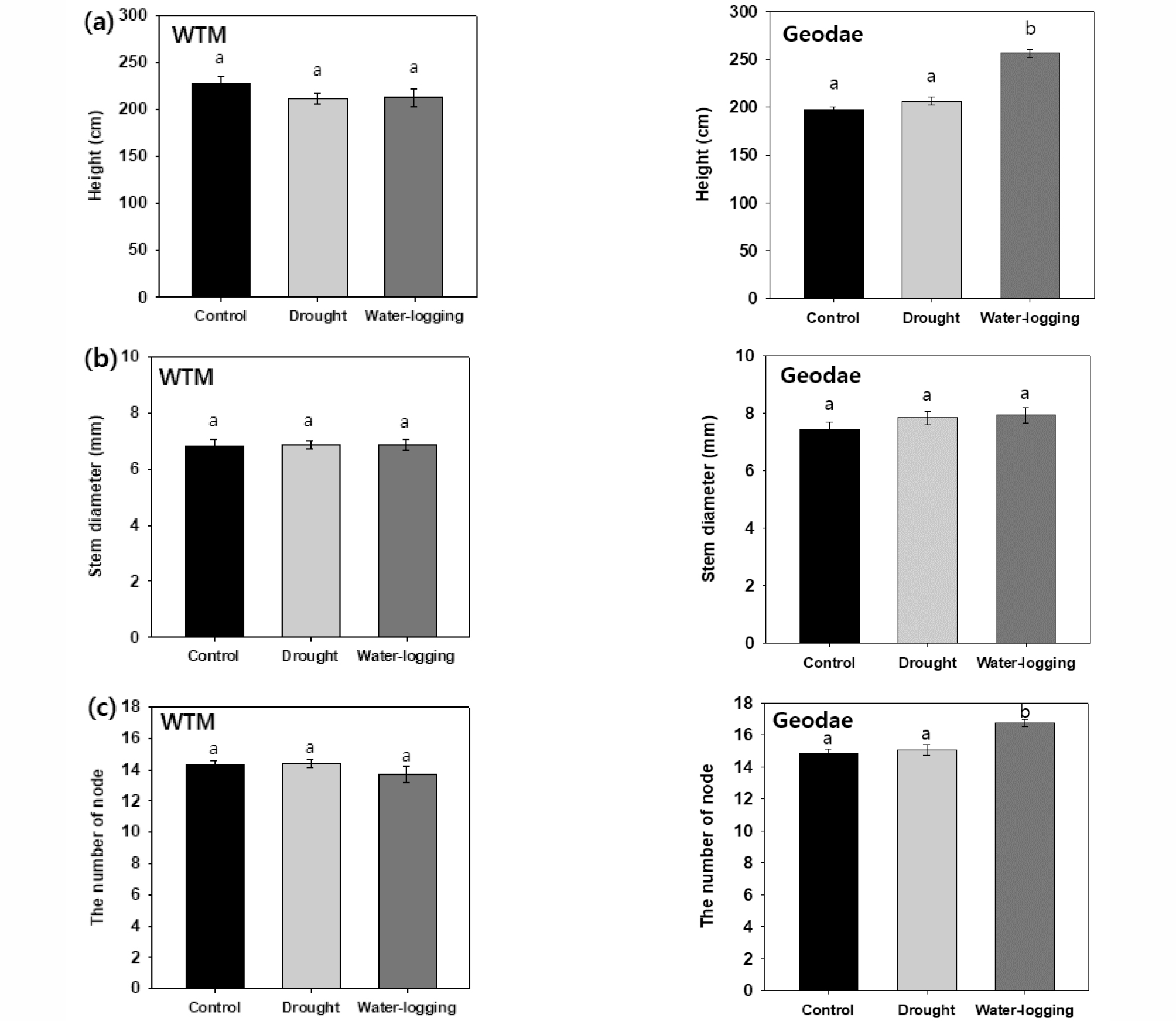
Fig. 3.
Morphological characteristics of two Miscanthus species after four months of three water condition treatments. Measurements during four months of three water conditions treatments included plant height (a), stem diameter (b), and the number of nodes (C). Bars represent the standard error. Different lowercase letters indicate significant difference at P < 0.05 by Tukey’s test.
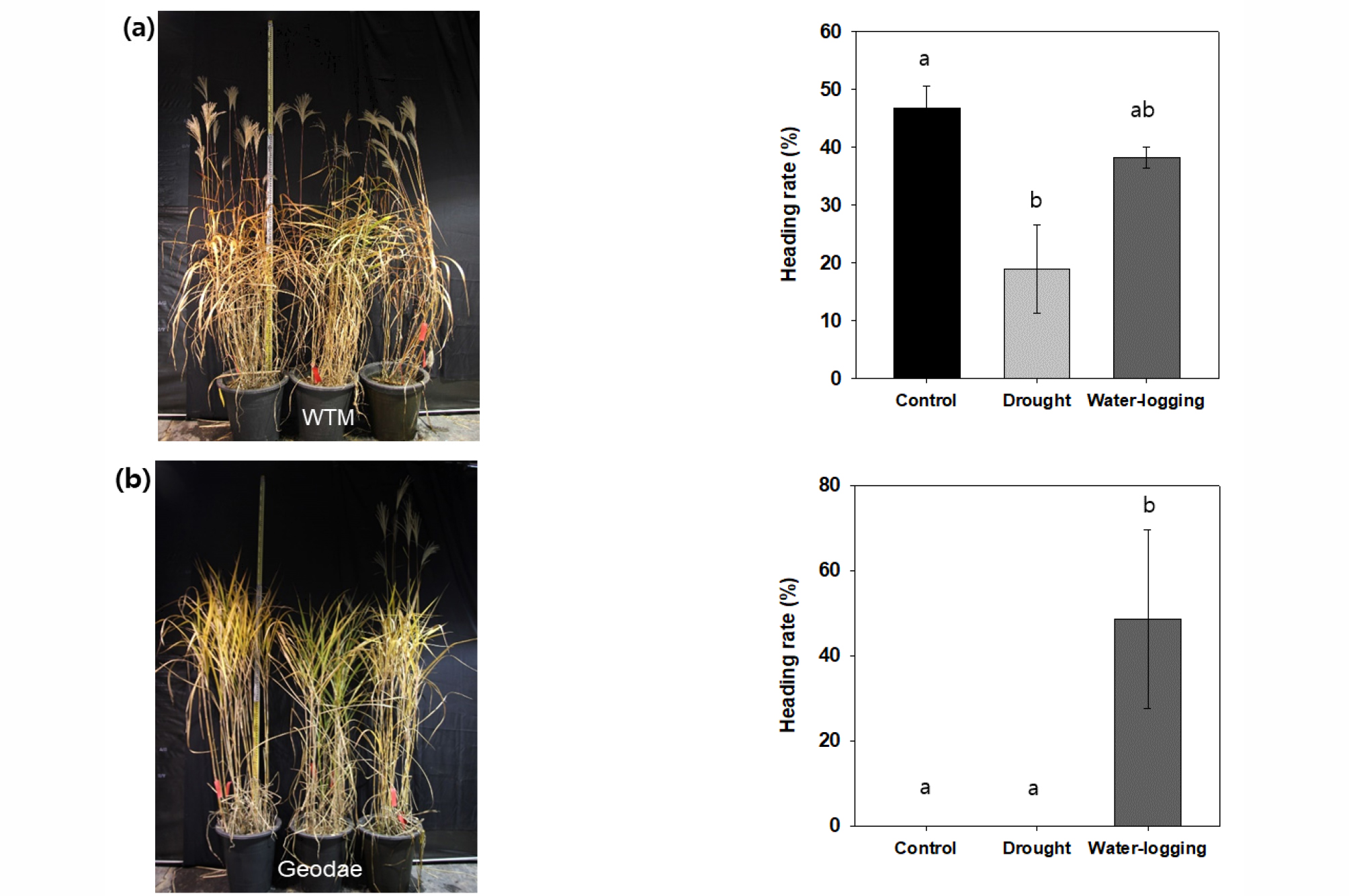
출수율의 경우, 물억새의 건조구에서는 대조구 46.7%에 비해 18.9%로 감소하였고, 침수구에서는 대조구와 통계적으로 유의한 차이를 보이지는 않았다(Fig. 4a). 반면, 거대1호의 출수율은 침수처리에 의해 48.6%로 증가하였으며, 대조구와 건조구에서는 0%로 나타났다(Fig. 4b). 기존 포장에 재식되어 있는 물억새와 거대1호의 출수율은 각각 56.1%, 15.1%로 포장 조건에서부터 거대1호의 출수율은 낮았으며, 포트에 재식한 대조구 물억새와 거대1호의 출수율 또한 각각 46.7%, 0%은 이를 반영한 결과이다(not shown). 거대1호는 맹아일로부터 생식생장기까지 소요되는 생육일수가 길어 타 물억새에 비해 바이오매스 생산량이 우수한 것으로 알려져 있으며, 이는 다른 물억새에 비하여 영양생장기간이 길어 바이오매스 축적양이 많은 것으로 알려져 있다(Moon et al., 2010; An et al., 2015). 또한 출수를 하지 않거나 늦게 출수하여 영양생장이 긴 억새 유전자원은 조기 출수하는 억새 유전자원에 비해 초장이 크고 바이오매스 수량이 많다고 보고되었다(Clifton-Brown et al., 2001).
물억새는 참억새에 비해 특히 경태가 굵은 종에서 북유럽, 중국 일부에서 개화가 잘 되지 않는다고 보고되었으며, 수분 부족은 억새의 출수 지연을 유발한다(Clifton-Brown et al., 2001; Jensen et al., 2012; Nunn et al., 2017). 거대1호의 경우, 타 물억새 종에 비해 경태가 굵고 초장이 커 바이오매스량을 확보하기 용이하나, 기존 연구결과와 같이 출수가 잘 되지 않음을 확인하였다.
억새의 화아분화는 12~14시간의 광주기에서 시작되며, 광주기를 15시간 이상으로 증가시켰을 시 출수가 지연되었으며 바이오매스량은 52%가 증가하였다(Jensen et al., 2012). 또한 수분환경 중 건조 조건에서도 참억새, 물억새 등 억새의 출수가 지연된다고 보고되었다(Jensen et al., 2011b). 또한 최근 연구 결과에서 물억새는 전체 개체가 출수하기 전에 연중 생육을 종료하여 유전자원별로 노화시기에 따라 출수율이 다양하였으며, 이질3배체 억새나 참억새에 비해 재배지역 별로 출수하는 유전자원의 수가 다르게 나타나 생육 환경에 따라 출수율 변이가 심하다고 보고되었다(Nunn et al., 2017).
수분스트레스 처리 후 억새 2종의 양분함량 변화
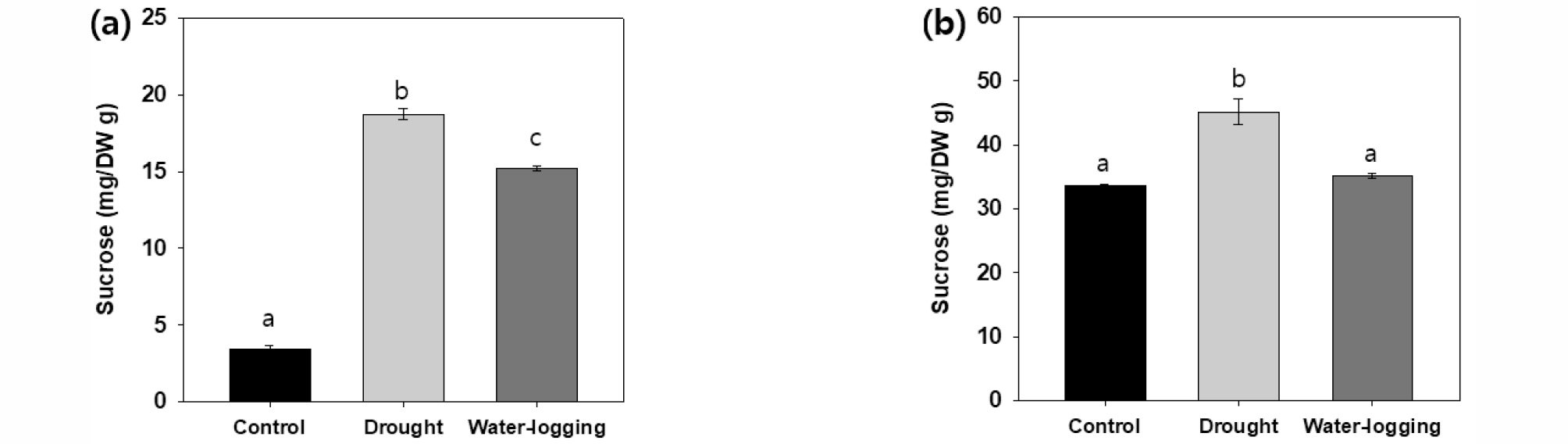
물억새와 거대1호의 유리당 함량은 수분 조건에 따라 차이를 보였다. 물억새의 유리당 함량은 건조구에서 18.7 mg/DWg로 가장 높았으며, 침수구에서 15.2 mg/DWg, 대조구에서 3.5 mg/DWg로 가장 낮았다(Fig. 5a). 거대1호의 유리당 함량 또한 건조구에서 45.1 mg/DW g으로 가장 높았으며, 대조구와 침수구는 차이를 보이지 않았다(Fig. 5b).
건조스트레스 조건하에서 물억새는 노화를 촉진하며, 급속한 노화는 광합성 산물, 양분의 이동을 저해한다(Clifton- Browon&Lewandowski, 2000; Purdy et al., 2015). 유리당은 전형적인 광합성 산물로 두 억새의 건조구에서 높은 함량을 보인 원인은 노화로 인한 양분 이동 저해로 인해 합성된 유리당이 아래로 이동하지 못한 것으로 사료된다.
무기영양분의 함량 조사 결과 또한 칼슘을 제외하고 두 억새의 건조구에서 가장 높게 나타났다(Fig. 6). 전질소 함량의 경우, 물억새와 거대1호에서 건조구에서 각각 26.0%, 20.3%로 가장 높게 나타났다. 물억새의 침수구는 대조구 17.3%보다 13.2%로 낮았고, 거대1호의 경우 대조구와 침수구간의 차이는 없었다(Fig. 6a, f). 인산함량 역시 두 억새 모두 건조구에서 각각 0.42%, 0.55%로 가장 높았다. 전질소와는 반대로 거대1호의 인산함량은 침수구에서 0.18%로 대조구 0.09%보다 높았으며, 물억새는 대조구와 침수구간의 통계적 유의성을 보이지 않았다(Fig. 6b, g). 칼륨의 함량은 두 억새에서 동일한 경향을 보였다. 물억새와 거대1호 모두 건조처리에 의해 칼륨함량이 각각 4.8 g/kg, 6.2 g/kg으로 대조구 3.5 g/kg, 4.4 g/kg에 비해 증가하였다. 반면 침수처리는 물억새와 거대1호의 칼륨 함량을 3.1 g/kg, 3.6 g/kg으로 감소시켰다(Fig. 6c, h). 마그네슘 함량 또한 칼륨과 동일한 경향을 보여, 물억새와 거대1호 모두 건조처리에 의해 함량이 증가하였으며, 침수처리에 의해 감소하는 경향을 보였다(Fig. 6e, j). 반면 칼슘의 함량은 다른 무기영양분 함량과 다른 경향을 보였다. 물억새의 칼슘함량은 대조구에서 1.8 g/kg으로 가장 높았으며, 건조구에서 1.5 g/kg으로 감소하였고, 침수처리에 의해 0.6 g/kg으로 감소하여 3배 이상 감소하였다(Fig. 6d). 거대1호의 칼슘 함량은 대조구와 건조구에서 통계적 유의성을 보지 않았으며, 침수구에서 0.6 g/kg으로 3배 이상 감소하였다(Fig. 6j).
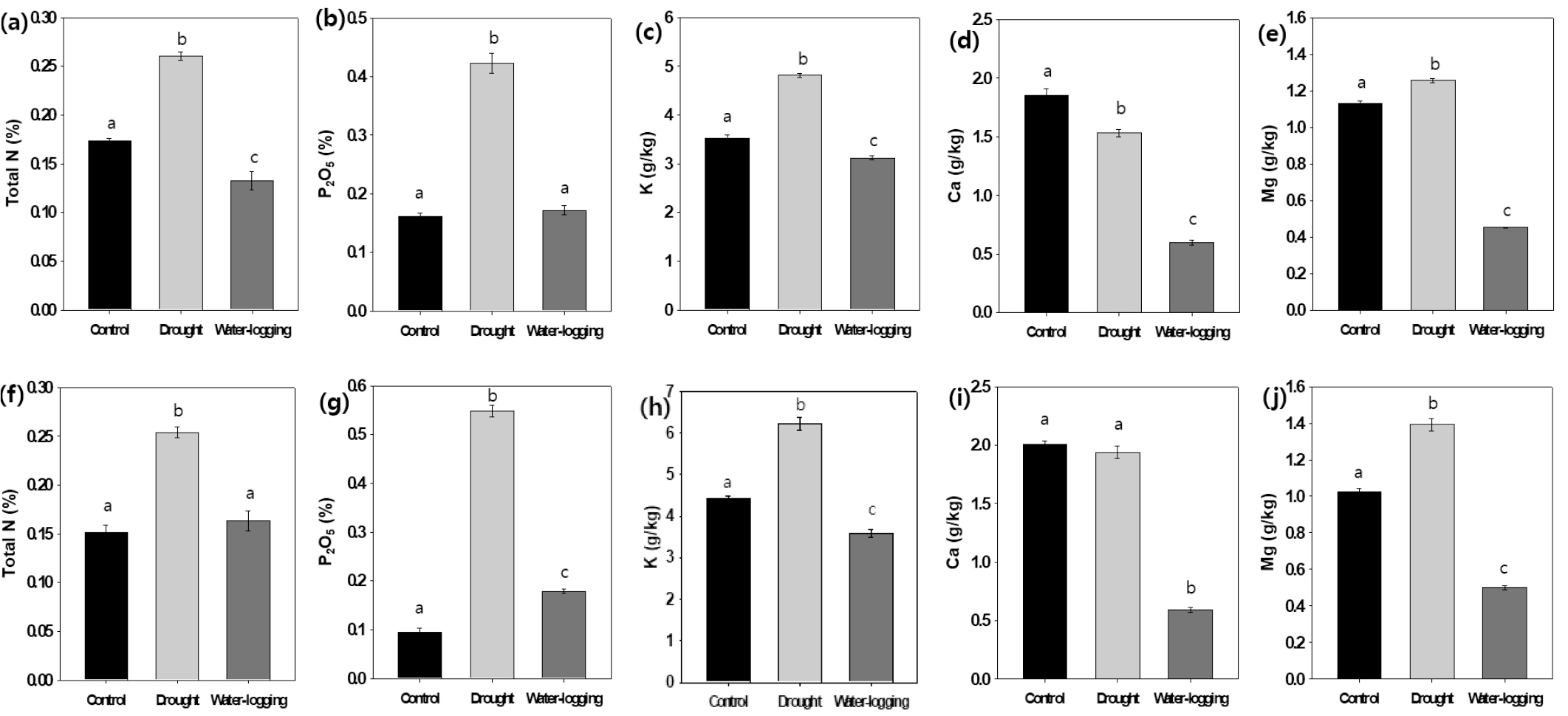
Fig. 6.
The mineral nutrient contents in two Miscanthus species after four months of three water condition treatments. The mineral nutrient contents measured were Total N {(a), {f)}, P2O5 {(b), (g)}, K {(c), (h)}, Ca {(d), (i)}, and Mg {(e), (j)}. (a)∼(e) WTM; (f)∼(j) Geodae. Bars represent the standard error. Different lowercase letters indicate significant difference at P < 0.05 by Tukey’s test.
억새는 생식생장기 초기인 7월경 지상부의 질소와 인산, 칼륨의 함량이 생육시기 중 최고에 도달한 후 8~9월부터 감소하기 시작한다(Beale&Long, 1997; Cadoux et al., 2012; Jørgensen, 1997). 특히 억새는 노화(senescence) 후 생장말기 양분을 지하경에 저장 후 이듬해 봄 지하경의 양분을 이용하여 생육을 재생한다(Jensen et al., 2011). 건조 스트레스에 노출된 억새는 이러한 노화 과정이 촉진되게 되고 지하경으로의 양분 이동이 전부 이루어지지 않은 채 지상부 생육을 종료하였을 것으로 사료된다(Fig. 6). Clifton-Brown&Lewandowski (2000)는 물억새가 건조 스트레스 조건하에서 놓일 경우 이를 저항하기 위한 기작으로 노화를 촉진시킨다고 보고하였는데, 이 결과 또한 우리의 결과와 일치한다.
칼슘과 마그네슘 또한 억새 6~7월경 지상부에서 가장 높은 함량을 보이며, 이후 감소하기 시작하나, 질소와 인산, 칼륨에 비하면 감소폭이 낮은 수준으로 보고되었다(Himken et al., 1997; Smith&Slater, 2010). 칼슘과 마그네슘은 노화에 의한 감소 수준이 낮은 양분으로 보고되었다(Himelblau&Amasino, 2001). 우리의 결과 또한 노화가 진행된 건조구가 아닌 침수구에서 칼슘과 마그네슘의 감소폭이 가장 컸다(Fig.6). 특히, 거대1호에서 침수구에서만 칼슘의 함량이 현저히 낮은 현상은 침수구에서만 출수한 결과와 연관이 있을 것이라 사료된다. 칼슘은 세포벽의 합성, 세포분열 중 방추사 형성에 주로 사용되며, 마그네슘은 DNA와 RNA의 합성에 관련된 효소 활성화에 역할을 하기 때문에 생식생장의 분열조직인 유수와 화기 생육과 연관되어 있다(Demarty et al., 1984; Taiz&Zeiger, 2010).
거대1호의 경우, 침수구에서만 출수가 진행되었고 이는 생식생장이 활발히 이루어진 결과이기 때문에 칼슘과 마그네슘의 함량도 현저히 낮아진 것으로 사료된다. 물억새 또한 침수구에서 마그네슘과 칼슘이 감소하였지만, 출수율 증가로 이어지지 않은 이유는 침수 처리가 물억새의 화아분화기 이후 이루어졌기 때문에 이미 화아분화기를 지난 개체에서는 침수처리에 의해 추가적인 화아분화가 이루어지지 않았기 때문으로 사료된다. 물억새는 거대1호에 비해 맹아기에서 생식생장기까지 소요일수가 짧아 이른 시기 화아가 분화된다(Ahn et al., 2015). 위 결과를 뒷받침하듯 우리는 추가적인 실험을 통해 2년간 재식한 물억새를 7월초가 아닌 5월 중순부터 장기간의 침수처리 하였을 시, 출수율이 77.6%에서 83.0%로 증가한 결과를 확인하였다(not shown).
억새의 수분스트레스 처리에 의한 생육변화는 주로 영양생장기에 수행되었다(Clifton-Browon&Lewandowski, 2000). 또한 최근 연구결과는 수분함량이 억새의 출수에 미치는 영향은 건조조건하에서 억새의 출수가 지연되고, 감소한다고 보고하였다(Nunn et al., 2017). 본 연구는 억새의 출수 촉진 요인이 단일 조건뿐만 아니라, 물억새의 경우 침수처리에 의해서도 촉진된다는 사실을 밝힌 최초의 결과이다. 이는 타작물에서도 거의 밝혀진 바가 없으며, 현재 재배되고 연구되는 작물의 생육조건이 주로 밭조건이기 때문에 물억새와 같이 자생지 조건이 습한 지역의 작물의 경우, 침수조건이 출수를 촉진 할 수도 있다는 점을 시사한다.
종합적으로 우리의 결과는 억새의 생식생장기 건조처리는 억새의 노화를 촉진하여 생육 종료를 앞당겼음을 확인하였으며, 침수처리는 물억새에서 출수를 촉진한다는 사실을 확인하였다.
적 요
생식생장기 장기간의 건조와 침수 스트레스 하에서 물억새와 거대1호의 생육 및 양분함량 변화를 비교분석한 결과는 다음과 같다.
1. 건조 처리에 의한 두 억새 종의 형태적 특성 변화는 없었으나, 침수 처리에 의해 거대1호의 초장은 256.6 cm로 증가하였으며 마디수 또한 16.8개로 증가하였다.
2. 물억새의 출수율은 건조 조건에서 18.9%로 감소하였으나 침수 조건에서는 대조구와 통계적 유의성을 보이지 않았다. 거대1호는 대조구와 건조구에서 모두 출수하지 않았으며, 침수처리에 의해 48.6%의 출수율을 보였다.
3. 주요 양분인 유리당, 전질소, 인산, 칼륨, 마그네슘은 두 억새 모두 건조처리구에서 가장 높았으며, 칼슘과 마그네슘의 경우 침수처리구에서 두 억새 모두 3배 이상 감소하였다.
4. 이러한 양분 변화는 건조처리에 의해 억새의 노화가 촉진되어 양분 이동이 저해된 결과로 사료되며, 침수처리는 거대1호의 출수를 촉진한다는 결과를 처음으로 확인하였다.