서 론
우리나라의 주식인 쌀은 2010년에 1인당 연간 소비량이 72.8 kg에서 2019년 59.2 kg으로 크게 감소하였다(KOSTAT, 2020). 반면 밀은 10년 전보다 생산량이 8.9% 늘었으며, 소비량 또한 8.7% 늘어 중요한 식용작물로 그 위상이 높아지고 있다(FAO, 2020). 더욱이 국내에서는 최근 밀산업육성법이 제정되고, 정부도 2022년까지 밀 자급률 9.9%를 목표로 하고 있어 밀에 대한 관심과 중요성이 크게 늘어난 것을 알 수 있다. 그러나 국산밀의 생산이 증가하지 못하는 것은 가공적성과 관련된 품질이 상대적으로 부족하고 작부체계 개선관 관련된 기술 개발이 미흡하여 재배면적 확대가 신속히 이루어지지 않고 있다.
질소는 작물 내에서 단백질과 엽록소 합성에 있어서 필수적인 요소이다. 작물에서 질소 시비는 초관 형성을 촉진해 엽면적 지수를 높여주고, 초관의 활성을 유지하는데 기여한다. 밀에서 질소 시비는 수량뿐만 아니라 품질면에서 중요한 역할을 한다. 우리나라의 경우 10a 당 2.5 kg의 시비보다 10a 당 7.5 kg의 시비 수준에서 단백질은 150%로 증가하였고, 글루텐 또한 168%로 증가한다고 보고되었다(Cho et al., 2018). 유사한 연구에서도 두 개의 품종에서 질소 무처리구 대비 질소 225 kg ha-1 처리로 글루테닌은 170%와 137%로, 글리아딘은 167%와 127%로 증가한다고 한다(Zheng et al., 2018). 그러나 질소 과잉 시비는 수분 이용효율과 질소 이용효율을 낮추고 상당한 질소 용탈을 유발한다는 연구(Xu et al., 2019)와 밀의 항산화 능력을 감소시키고 대사 변화를 통해 종실 발달에 악영향을 미친다는 결과를 고려하면(Kong et al., 2017), 단순한 수량과 품질 증대 외에 지속 가능한 농업을 위해서는 질소 시비량의 최적화가 필요하다.
초분광 분석은 1972년 ERTS-1 (Earth Resources Technology Satellite-1) 개발을 통한 지구 이미지 분광법 개발 이후 빠르게 발전하고 있다. 이후 분광 데이터 해석을 위해 휴대용 포장반사분광계 개발이 촉진되었고, 초분광카메라 발전에 따라 토양, 광물, 건축 등으로 활용범위가 확대되었다(Goetz, 2009). 또한 스펙트럼 촬영 기기의 소형화가 이루어지면서 농업에서도 활용성이 증가되고 있다. 다중분광스펙트럼 카메라를 활용한 식물병 탐지(Nutter, 1989), 질소 상태 진단(Reyniers et al., 2006), 활력 진단(Wijitdechakul et al., 2016)등으로 이용성이 확대되었으며, 초분광 분석으로 식물 분포(Siegal et al., 1977), LAI 추정(Darvishzadeh et al., 2008), 엽록소 함량 추정(Wu et al., 2008), 바이오매스와 질소 농도 추정(Li et al., 2010), 식물병이나 스트레스 확인(Lelong et al., 1998, Rumpf et al., 2010; Mahlein et al., 2010; Ashourloo et al., 2014; Behmann, et al., 2014), 수량 예측(Cao et al., 2015)등 다양한 분야에 활용되고 있다. 특히 초분광 분석은 비파괴적으로 식물의 영상 데이터에 기반하여 다양한 특성을 빠르게 분석할 수 있고 다양한 활용이 가능하다.
우리나라에서는 아직까지 초분광카메라를 활용한 작물 분석연구는 거의 없어 작물의 분광학적 특성파악을 위한 영상 연구가 필요하다. 특히 국내에서 밀 재배에 관련되어 질소 시비와 초분광 특성간의 관계에 대한 연구는 전무하다. 본 연구는 밀의 질소 추비 조건에 따른 생육 단계별 분광학적 특성 변화를 확인하여 적절한 시비 조건을 구명하고, 더불어 주요 생육 특성에 어떠한 영향을 주는지를 초분광 영상 데이터에서 추출된 다양한 식생지수에 근거하여 확인하고자 수행하였다.
재료 및 방법
재배방법 및 질소 시비 처리
본 연구의 포장 시험 지역은 경상남도 진주시 가좌동에 위치한 경상대학교 부속농장 전작포장(35°08'57.5"N 128°05'49.2"E)에서 수행되었다. 시험 포장은 사질 양토로 N, P, K 함량이 각각 74 mg kg-1, 5.1 mg kg-1, 80 mg kg-1이었다. 시험 품종으로는 국내에서 육성된 경질밀 품종인 조경밀을 이용하였다. 파종 전 경운 및 기비 처리 후, 2019년 10월 30일에 재식거리 25 cm X 10 cm로 세조파(파종량 14 kg 10a-1)하였다. 시비량은 10a 당 N-P2O5-K2O를 성분량 기준 9.1-7.4-3.9 kg 시용하였고, 인산과 칼륨은 전량 기비로 처리하였다. 파종 후 제초제 처리는 티오벤카브 입제를 2 kg 10a-1 살포하였다. 기타 재배관리는 농촌진흥청 밀 표준 재배법에 준하였다. 질소 시비는 요소 비료를 이용하여 모든 질소 시비 처리구에 기비와 1차 추비는 같은 양을 시용하였다. 기비와 1차 추비의 시용량을 각각 3.64 kg 10a-1와 2.74 kg 10a-1로 처리하였다. 이차추비는 2020년 3월 13일에 3 수준의 질소 시용량을 무처리(0%)인 0 kg 10a-1, 표준량(30%)인 2.73 kg 10a-1, 및 과량(60%)인 5.46 kg 10a-1으로 포장 시험구에 각각 처리하였다. 종합적으로 질소 시비량은 기비 40%, 1차 추비 30%가 처리되었고, 2차 추비(0%, 30%, 60%)에 따라 N4:3:0, N4:3:3, N4:3:6으로 구분하였다.
생육조사
포장 조사는 밀의 신장기, 유숙기에 해당하는 2020년 3월 19일과 2020년 4월 29일에 생육 및 생리적 형질들을 조사하였다. 생육조사는 초장과 엽면적 지수를 조사하였고, 생리적 특성 조사는 완전 전개한 첫번째 상위엽에서 휴대용 엽록소계(SPAD-502, Minolta, Osaka, Japan)를 이용하여 엽 녹색도(SPAD value)와 형광측정기(OS-30P, Opti-sciences, Hudson, NH, USA)를 이용한 엽록소 형광(Fv/Fm)을 측정하였다. 마지막으로 2020년 6월 9일에 1 m × 3줄의 지상부를 수확하여 수량 관련 형질을 조사하였다. 광합성은 휴대용 광합성측정기(CID-340, Bio-Science, USA)를 이용하여 최상위 엽을 대상으로 맑은 날 10:00-14:00에 측정하였다. 엽면적지수는 휴대용 엽면적 측정기(LP-80, Decagon Devices, USA)를 이용하여 측정하였다.
밀엽의 분광학적 특성 분석
초관의 색 변화를 확인하기 위해 드론을 이용해 45 m 고도에서 포장을 촬영하였다. 촬영은 구름이 없는 맑은 날에 실시하였으며, 사진 해상도는 3840 X 2160, F/2.2, 노출 시간은 1/1923초로 3월 19일, 4월 29일 촬영하였다. 촬영된 영상 데이터는 ENVI 5.1 (Exelis Visual Information Solution, Inc. Pearl East Circle Boulder, Co, USA)을 이용하여 포장에서 전체적인 RGB 평균값을 추출하였다.
질소 시비 수준에 따른 밀 엽의 초분광학적 특징을 알아보기 위하여 초분광카메라(Specim IQ, Specim Ltd, Oulu, Finland)를 이용하여 밀의 완전 전개된 최상위엽을 기준으로 잡아 약 20 cm 높이에서 촬영하였다. 촬영 시 지상과 평행하게 카메라를 위치하였고 빛은 태양광으로, 구름 없는 맑은 날에 촬영하였다. 카메라의 광 보정을 위해 reference plate는 파장범위에 100% 반사율을 지니는 99% barium sulfate를 이용하였다. 촬영한 이미지는 ENVI 프로그램을 이용하여 가시광선부터 적외선까지 파장 반사값을 추출하여 식생지수를 분석하였다.
시험구 배치 및 통계처리
시험구 배치는 난괴법 3반복 수행하였고 시험구 면적은 54 m2 이었다. 얻어진 데이터는 SAS 프로그램(ver. 9.4 SAS Inst., North Carolina, US)을 이용하여 Proc ANOVA로 분산분석을 실시하고 DMRT (Duncan’s multiple range test)를 통해 p < 0.05 수준에서 평균값을 비교하였다.
결과 및 고찰
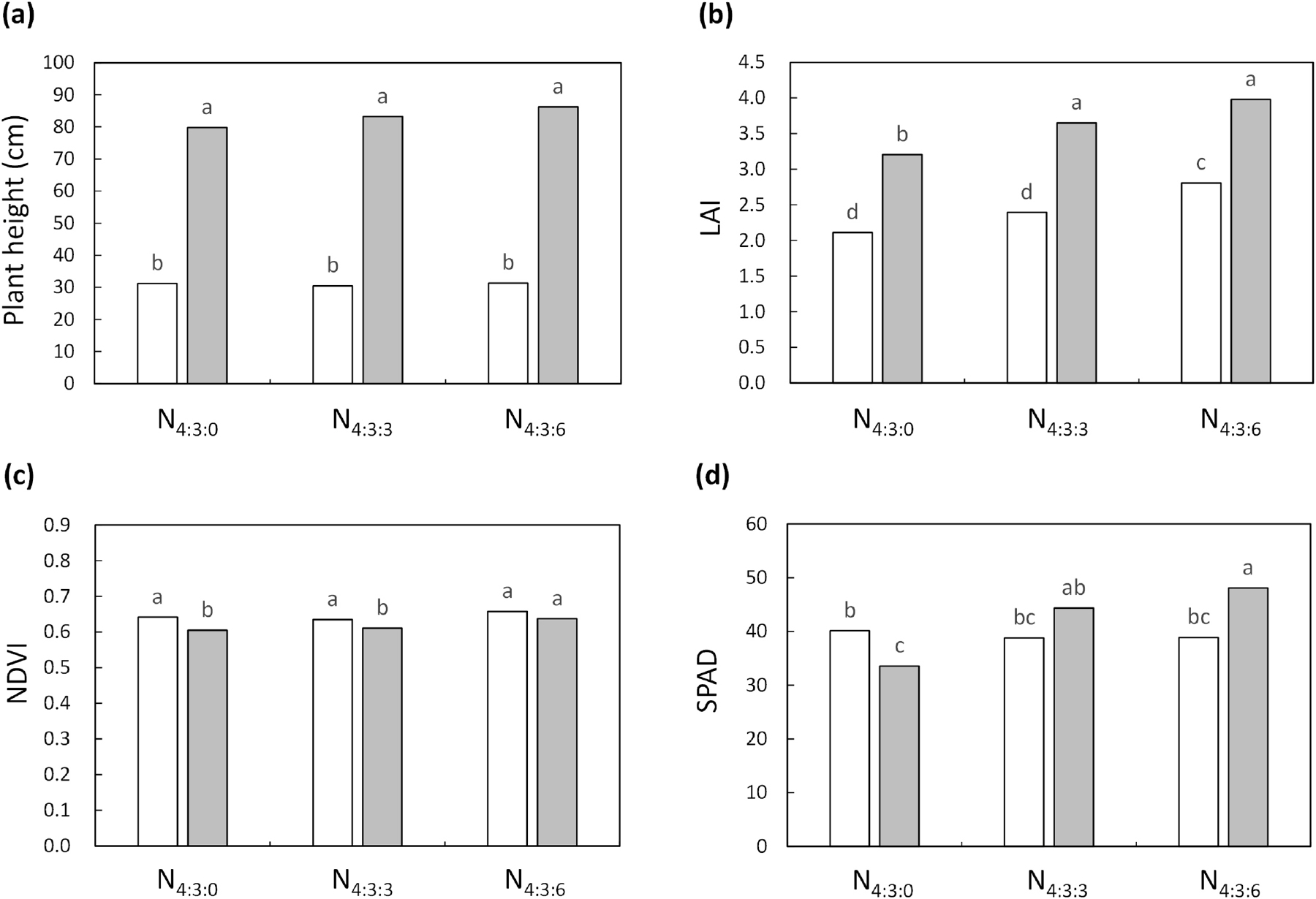
밀의 질소 시비별 생육 특성을 보면 초장은 3월 19일과 4월 29일 모두 차이가 없었으며, LAI는 유숙기에서 무처리 대비 추비 처리구에서 차이를 보였다(Fig. 1). NDVI는 3월 19일 모든 처리에서 통계적으로 유의하지 않았지만, 4월 29일에는 3월 19일보다 전체적으로 값이 낮아졌다(Fig. 1c). 엽록소 수치를 나타내는 SPAD는 3월 19일에 40에 가까운 값을 보여주었고, 4월 29일에는 추비량이 많을수록 높게 나타났다(Fig. 1d).
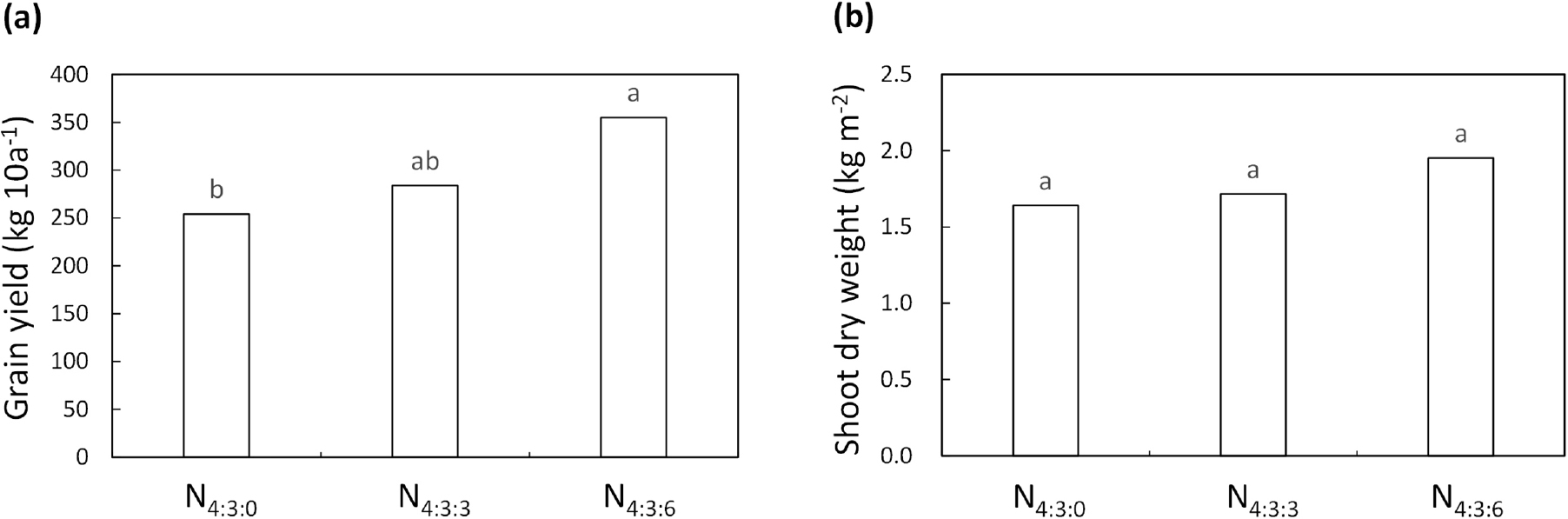
질소 수준에 따라 초장과 LAI의 변화에 대한 선행 보고들을 고려할 때 질소 시비량 증가는 초장과 LAI의 증대에 따른 광합성 효율증가로 이어져, 최종적으로 종실중(Fig. 2a)과 건물중(Fig. 2b)에도 긍정적인 영향을 준 것으로 판단되었다(Amanullah et al., 2009; Xingyun et al., 2019; Luo et al., 2020). Red와 infrared 영역을 사용하는 NDVI는 위성 데이터 기반의 분광학적 분석을 통해 식물 건물량과 관련이 있는 것으로 알려졌고(Rouse et al., 1974), 스트레스나 광 흡수 효율이 떨어질 때 가시광선 반사율은 증가하고 적외선 영역은 반사율이 감소한다. 따라서 4월 29일에서 3월 19일보다 생육 진전으로 인한 전체적인 잎의 노화가 진행된 것으로 확인되었고, 질소 과량 처리구인 N4:3:6은 스트레스가 적고 노화 지연이 있었던 것을 확인할 수 있었다. 그리고 시비 증가로 2차 추비 무처리구 대비 SPAD값이 높게 나왔는데, 이것은 4월 29일에도 엽록소 함량을 유지시켜 광합성을 잘 할 수 있도록 추비의 효과가 나타난 것을 알 수 있었다(Netto et al., 2005; Fritschi & Ray, 2007). 따라서 시비량 증가로 지상부의 생리적 활성 유지 기간이 연장되어 건물중과 종실중 증가에 기여한 것으로 판단된다.
영상 데이터는 NDVI와 같은 식생지수 산출뿐만 아니라 머신러닝을 통한 바이오매스 모델링(Han et al., 2019), 수량 및 식물병 탐지(Nebiker et al., 2016), 토양 염도 모니터링(Ivushkin et al., 2018)등 다방면에 쓰이고 있다. 또한 RGB 데이터의 경우도 바이오매스 예측(Bendig et al., 2014), 유묘의 출현 예측(Li et al., 2019), 수분 스트레스 모니터링(Zhang et al., 2019)등으로 활용된다.
ENVI로 추출한 RGB값은 3월 19일에는 큰 차이를 보이지 않았다. 그러나 4월 29일에는 질소 2차추비 수준이 N4:3:0으로 낮아질수록 RGB값의 Red, Green, Blue가 전체적으로 높아지고 특히 Red, Green 값이 높아진 것을 확인할 수 있었다(Fig. 3).
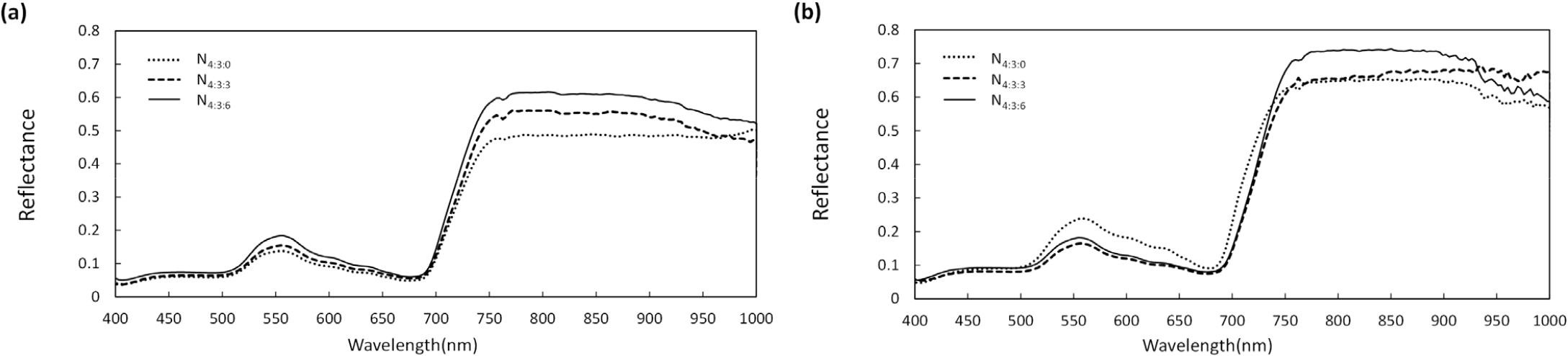
녹색잎을 지닌 식물은 엽 내부의 산란으로 인하여 700 nm이상에서 급격한 상승을 보이고, 근적외선 영역에서 반사율이 높다고 알려져 있다(Mishra, 2017; Peñueulas & Filella, 1998; Reyniers et al., 2006). 식물 엽록소와 관련해서 550 nm, 710 nm와 620 nm, 700 nm 가시광선 영역도 엽록소 함량이 감소하면 반사율이 증가하고, 파장대가 900 nm보다 큰 파장 영역은 식물 수분과 관련되어 있어 충분한 수분 상태일때 반사율이 높고 950 nm에서 감소하며, 식물 수분 함량이 감소하면 전체적으로 반사율이 낮아진다는 보고가 있다(Peneulas & Filella, 1998).
본 연구의 초분광 분석 결과 신장기인 3월 19일에는 추비 수준이 낮아질수록 750 nm부터 1000 nm까지 반사율이 낮았으며, 가시광선 영역에서도 큰 차이가 나지 않고, 전체적인 시비별 그래프가 유사했다. 하지만 유숙기인 4월 29일에는 2차 추비가 이루어진 N4:3:6과 N4:3:3에서는 400~700 nm 영역이 3월 19일과 동일했지만 무처리인 N4:3:0에서는 400~700 nm 영역애서 반사율이 올라간 것을 알 수 있다. 이를 통해 질소 시비가 엽록소 함량을 줄여 반사율이 높아진 것을 확인할 수 있었다. 또한 498~715 nm에서 노화와 관련이 있다는 연구 결과를 고려할 때(Carter, 1993), N4:3:6와 N4:3:3은 3월 19일과 비슷한 반사율인 것으로 보아 질소추비가 엽의 노화를 지연시킨 것으로 보인다. N4:3:0에서는 반사율 증가가 나타나 노화가 진행된 것을 확인할 수 있었다. 잎 내부에서 일어나는 빛의 산란에 따라 700 nm보다 긴 파장에서 반사율의 급격한 증가를 관찰할 수 있었다. 체내 수분 함량과 관련이 있는 950 nm에서 신장기때 모든 처리구에서 감소되지 않았으나 출수 이후 등숙이 일어나는 4월 29일의 결과를 보면 다른 추비 처리에 비해 N4:3:6 처리에서 반사율의 급격한 감소가 나타났다. Feng (2008)이 보고한 초분광과 엽 질소 농도 및 축적의 상관관계에 따르면, 400~700 nm에서는 질소량이 증가할수록 반사율이 감소하고, 780 nm에서 1100 nm에서는 질소량이 증가할수록 반사율이 높아진다고 한다. 이를 통해 질소 시비의 효과가 명확하게 드러나지 않는 3월 19일에서 N4:3:6으로 갈수록 NIR이 높은 것과, 4월 29일에서 N4:3:6에서 가시광선 영역의 감소와 780 nm 후반의 NIR 영역이 높은 것은 질소 시비와 상관이 있음을 추정할 수 있다. 가시광선 영역 중 장파장에 속하는 670~780 nm의 red-edge 구간은 엽록소 양이 증가하면 엽록소 흡수 기능이 좋아져 파장이 길어지는데, Fig. 4에서 무처리인 N4:3:0에서 red-edge 구간이 추비량이 많은 시험구에 비해 반사율이 높아진 것을 확인할 수 있어 초분광카메라의 반사율 특성을 통해 다양한 정보 확인이 가능한 것을 알 수 있다.
초분광 데이터에서 식생지수 산출을 위해 주요 파장의 분광값을 추출하여 주요 식생지수들을 구하였다. SRI (Birth & McVey, 1968)는 식물을 간단하게 평가할 수 있는 지수로 엽색이 진할수록 값이 크다. SRI 값은 초기 3월 19일에는 N4:3:0에서 조금 높았지만 큰 차이는 보이지 않았다. 하지만 4월 29일에는 N4:3:6과 N4:3:3이 높고 N4:3:0이 가장 낮았다. 이는 엽색과 관련이 있는 RGB값(Table 1)과 SPAD (Fig. 1d)와 비교했을 때에도 3월 19일, 4월 29일에 모두 같은 경향을 보였다.
Table 1.
Spatial variation in red, green, and blue intensity (RBG) values obtained from photos taken in wheat fields.
| Color | Mar. 19 | Apr. 29 | |||||
| N4:3:0 | N4:3:3 | N4:3:6 | N4:3:0 | N4:3:3 | N4:3:6 | ||
| R | 70 | 69 | 63 | 107 | 92 | 63 | |
| G | 121 | 122 | 116 | 127 | 116 | 93 | |
| B | 82 | 83 | 80 | 89 | 85 | 71 | |
포장에서 휴대용 NDVI 측정기를 이용해 측정한 NDVI (Fig. 1)와 초분광데이터에서 추출한 NDVI (Table 2) 값 간에는 차이를 보였다, 이는 측정 부위를 개엽을 대상으로 하는 휴대용 측정기와 전체엽을 대상으로 하는 초분광카메라의 측정 방식의 차이 때문인 것으로 사료된다. 그러나 두 방식 모두 4월 29일에는 N4:3:6에서 N4:3:0으로 갈수록 시비에 따라 높아지는 결과를 보여주었다. 이는 앞서 서술한 것과 같이 4월 29에는 완전히 초관이 형성되고 생리적으로 잎의 노화에 진행 되어 NDVI 값이 감소하였기 때문으로 보인다. Red-edge-NDVI와 MRE-NDVI는 식물 개체나 내부구조, 노화 등의 변화에 민감한 red-edge를 사용하여 측정한다(Gitelson & Merzlyak 1994; Datt, 1999). 이 식생지수에서도 NDVI와 같은 경향을 볼 수 있었다. 그러나 NDVI와 달리 감소 폭이 커 시비 수준이 높은 N4:3:6의 개체가 보다 건강하며 N4:3:0으로 갈수록 노화가 빨리 이루어지는 것을 더욱 잘 파악할 수 있었다. 따라서 밀에서 시비 효과 평가에는 NDVI보다 Re-NDVI가 보다 효과적인 것을 보여진다.
Table 2.
Vegetation indices calculated with spectral reflectance values using a hyperspectral camera.
NDVI1 - (R800-R680)/(R800+R680), Re-NDVI2 - (R750-R710)/(R750+R710), MRE NDVI3 - (R750-R705)/(R750+R705-2*R445), NRI4 - (R570-R670) - (R570+R670), GI5 - R570/R670 SRI6 - R900/R680, GNDVI7 - (R750-R550)/(R750+R550), VOG REI18 - R740-R720, PRI9 - (R531-R570)/(R531+R570), PSRI10 - (R680-R500)/R750, SIPI11 - (R800-R445)/(R800+R680), BI12 - R450/R490, PSSRa13 - R800/R680, PSSRb14 - R800/R635, PSSRc15 - R800/R500, CI16 - R515/R570, RI17 - R700/R670, PhRi18 - (R550-R531)/ (R550+R531), GCI19 - (R780-R550)-1
BI (blue index)는 엽록소 함량과 식물 병에서 나오는 지수로(Calderón et al., 2013), 3월 19일에서 N4:3:3이 가장 낮고 나머지 시비에서는 높았다. 본 연구에서 4월 29일에는 시비에 따라 N4:3:6, N4:3:3은 유사했으며 N4:3:0에서는 크게 감소한 것을 확인할 수 있었다. GI (greeness index)는 3월 19일에서 N4:3:6에서 높았고 N4:3:0에서는 낮았다. 4월 29일에는 N4:3:6, N4:3:3은 유사했으며 N4:3:0에서 높았다. BI와 GI는 다른 연구에서 식물병 탐지에 사용한 지수로 BI는 병이 심할수록 감소하는 경향을 보인다. 하지만 GI는 BI와 비교했을 때 식물병 탐지에 적합하지 않다고 알려져 있다(Calderón et al., 2013). 이러한 결과를 고려하면 본 연구에서는 병에 의한 영향보다는 엽록소 함량의 감소와 노화 스트레스로 지수 감소가 발생한 것으로 추정되었으며, GI는 질소 시비 수준에 따른 영향을 분석하기에 제한적이었다.
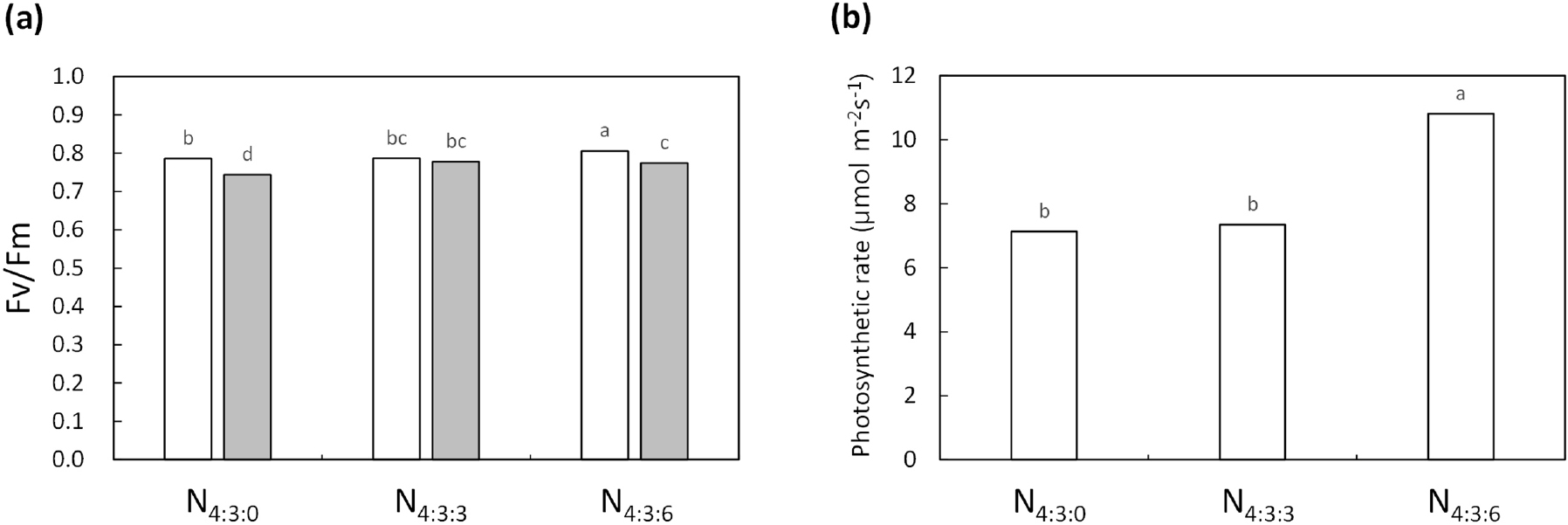
PRI (photochemical reflectance index)는 카로티노이드와 엽록소 비율 및 광이용효율과 관련 있어 Fv/Fm 값과 관련이 있다(Sims & Gamon, 2002; Peñuelas et al., 1995). PRI 지수는 높을수록 광이용효율이 높다. 본 연구에서 3월 19일에는 N4:3:0이 조금 높았지만 4월 29일에는 N4:3:6이 가장 높고 N4:3:0은 3월 19일보다 더 낮아진 것을 확인할 수 있었다. 이는 4월 29일에 N4:3:0에서 다른 2차 추비 처리구에 비해 Fv/Fm과 광합성률이 낮은 것과 밀접한 관련이 있는 것으로 보인다(Fig. 5).
Vog REI1와 PSSRa, PSSRb, GNDVI, GCI (green chlorophyll index)는 엽록체 함량과 관련이 있는 지수이다(Vogelmann et al., 1993; Blackburn, 1999; Mahlein, 2010; Gitelson & Merzlyak, 1998; Gitelson et al., 2003). 이들 값은 3월 19일의 SPAD 측정 결과와 큰 차이가 없었지만 모든 지수가 N4:3:3에서 높았고 N4:3:6, N4:3:0에서 조금 낮아졌다. 4월 29일에 GNDVI, GCI는 N4:3:6과 N4:3:3이 비슷하고 N4:3:0에서 큰 폭으로 하락하였다. 그 외 지수들은 질소 시비 수준이 낮을수록 값이 낮았다. 엽록체 함량 측정에 있어서 유기용매를 이용한 파괴적 추출방법은 시간과 노력이 많이 소요된다(Mckinney, 1941; Moran, 1982). 그러나 SPAD meter와 같은 분광 특성을 이용한 휴대용 엽록소 측정기의 개발로 신속한 엽록소 함량 평가가 가능해지고 이를 질소 시비량 추정에 활용하고 있다. 최근 초분광카메라의 발전으로 다양한 식생지수 산출이 가능하고, 특정 밴드의 반사율을 이용한 엽록소 함량의 추정도 확인되었다. 특히 다양한 생육 단계에서 초관 수준의 엽록소 함량 분석에 활용할 수 있었다. 본 연구에서도 4월 29일에서 N4:3:6 대비 N4:3:3의 감소 폭보다 N4:3:3 대비 N4:3:0의 감소 폭이 더 크게 나타나 2차 추비를 실시하지 않는 경우 개체 내 엽록소 함량이 크게 낮아져 광합성에 크게 영향을 주었다(Figs. 1 and 5).
엽의 질소 상태 파악을 위해 이용되는 RI (redness index)와 NRI (nitrogen reflectance index)는 작물 재배 포장에서 활용되는데(Gitelson et al., 1996; Filella et al., 1995). 3월 19일에는 큰 차이를 보이지 않았으나 4월 29일에서 추비량이 줄어들수록 값이 높아지는 경향을 보여주었다. SIPI (structure independent pigment index)는 카로티노이드계 색소와 엽록소 비율을 나타내는 지수이고 PSRI (plant senescence reflectance index)는 역시 카로티노이드, 엽록소 비율을 보여주며 노화를 감지할 수 있는 지수이다(Peneulas et al., 1995; Merzlyak & Gitelson 1999). SIPI는 3월 19일에 N4:3:3에서 소폭 높았지만 시비량 간 큰 차이는 없었고 4월 29일에는 N4:3:0으로 갈수록 증가하는 것을 보여주었다. PSRI는 3월 19일에서 N4:3:3에서 가장 높았으며 4월 29일에는 N4:3:0에서 가장 높은 것을 알 수 있었다. PSRI는 엽색이 진한 식물의 경우 0에 가까운 음의 값을 보이며 노화가 진행되면 양의 값을 나타내는데, 본 연구에서는 4월 29일에서 추비량이 낮을수록 더 높은 값을 보여 엽의 활력이 점차 낮아짐을 나타냈다.
CI (carotenoid indices)는 작물의 수분스트레스와 관련이 있는 것으로 보고되었는데(Zarco-Tejada et al., 2012), 3월 19일에서 질소 시비량이 낮을수록 소폭 증가하였다. 이후 4월 29일에는 BI와 마찬가지로 질소 시비량이 낮을수록 큰 폭으로 감소하는 것을 확인할 수 있었다. PRI (photochemical reflectance index)와 PhRi (the physiological reflectance index)는 유사한 특징을 보이는 지수들로서 본 연구에서 PhPi는 3월 19일에서 N4:3:3에서 조금 높았다. 이후 4월 29일에는 질소 시비량이 낮을수록 그 값이 증가하는 경향을 보여주었다. PRI와 PhRi는 질소 스트레스에 의해 증가하는 지수들로(Gamon et al., 1992), 본 연구에서는 질소 시비량이 낮을수록 소폭 증가하여 앞선 연구 결과와 일치하였다.
적 요
적절한 질소 시비는 작물에 초형을 개선하는 한편, 엽록소 유지에도 도움을 주어 엽노화를 억제하고 광합성도 증대시켰다. 드론을 활용해 얻어진 잎의 RGB 값은 4월 29일에서 추비량 증가에 따라 RGB 값의 뚜렷한 차이를 나타내 단순한 엽색 분석도 작물의 생리적 상태 평가에 활용할 수 있음을 보여주었다. 휴대용 측정기를 이용한 실험에서 추비 조건에 따른 NDVI와 SPAD 값은 3월 19일에 큰 차이 확인할 수 없었다. 그러나 초분광카메라를 통한 분석에서 추비량 증대에 따라 780 nm보다 큰 파장대인 NIR 영역에서 반사율 증가가 확인되었다. 이는 시비 효과가 명확히 드러나지 않는 생육 초반에도 초분광카메라 활용해 작물 상태를 진단할 수 있음을 보여준다. 포장에서 추비 수준이 낮을수록 4월 29일에는 가시광선 영역의 반사율이 증가하고, NIR 영역의 감소가 확인되어 시비에 따른 영향을 확인할 수 있었다. 초분광카메라를 이용한 식생지수 확인으로 엽록소 함량, 질소 부족 정도, 광합성 상태 분석에 근거한 시비 효과 평가가 가능하였다.