서 론
재료 및 방법
식물재료 및 제부라린 처리
제부라린 처리를 통한 유사분열 중기염색체 관찰
통계 분석
결과 및 고찰
제부라린이 보리 생장에 미치는 영향
체세포 분열 중기 염색체 이상
적 요
서 론
제부라린(zebularine)은 시티딘 유사체(cytidine analog)로써 DNA 메틸화 억제제(DNA methylation inhibitor)로 알려져 있다. 제부라린은 종양 형성(tumorigenesis) 억제 효과가 있어 DNA 탈 메틸화(DNA demethylation)와 암(cancer)과의 관계를 확인하기 위한 항암물질(anticarcinogen substance)로 연구되어 왔다(Cheng et al., 2004; Balch et al., 2005; Yang et al., 2013). 제부라린은 1960년대에 처음 합성되어 항암물질로 연구되어 온 DNA 메틸화 억제제인 5-아자시티딘(5-azacytidine)과 5-아자-2’-데옥시시티딘(5-aza-2’- deoxycytidine)보다 상대적으로 수용액의 안정성(stability of aqueous solution)이 좋고 낮은 독성(toxicity)이 확인되었다(Piskala & Sorm, 1964; Christman, 2002; Marquez et al., 2005; Rao et al., 2007).
DNA 메틸화 억제제는 동물세포 뿐만 아니라 식물세포에서도 DNA 절단(DNA breakage)을 유발하여 염색체 절단(chromosome breakage)으로 이어지며, DNA 복구(DNA repair)를 통하여 최종적으로 염색체 재조합(chromosome recombination)의 원인으로 작용한다(De Las Hedras et al., 2001; Orta et al., 2013). 염색체 재조합을 확인하기 위하여 외래 염색체 첨가 밀 계통(wheat disomic addition line)과 8배체인 라이밀(triticale)에 제부라린을 처리하여 밀 염색체와 외래 염색체 사이에서 재조합을 확인하였다(Cho et al., 2011; Ma et al., 2016). 최근 빵용 보통밀(Triticum aestivum L.)에 제부라린을 처리하여 개화기 관련 유전자 FT (flowering locus T1)-B1의 소실(deletion)을 유발하여 생식생장(reproductive growth)을 지연시킴으로써 이삭발달 기간이 연장되어 영화수(spikelet number)의 증가를 유도하였다(Finnegan et al., 2017).
체세포 분열(mitosis) 및 생식세포 분열(meiosis) 동안 염색체 절단 및 재조합과 같은 염색체 행동(chromosomal behavior)을 관찰하기 위해서는 염색체의 크기는 중요한 요소로 작용한다. 보리(Hordeum vulgare L.)는 2배체(diploid, 2n = 2x =14, HH) 작물이며, 게놈의 크기가 5.3 Gb로 게놈의 크기가 큰 작물 중에 하나로 벼(Oryza sativa L.)의 게놈(430 Mb)보다는 11배 크며, 애기장대(Arabidopsis thaliana)의 게놈(135 Mb)보다는 35배 크다(Mascher et al., 2017, Beier et al., 2017). 일반적으로 염색체의 크기가 큰 보통밀(Triticum aestivum L.)은 염색체 행동을 관찰하기 좋지만 6배체 작물로 염색체 수가 42개임으로 염색체 관찰은 쉽지 않으며 숙련도에 따라 결과의 해석이 달라질 수 있다. 보리는 염색체 수가 14개로 보통밀에 비하여 수가 적을 뿐만 아니라 체세포 분열 및 생식세포 분열 동안 염색체 행동을 관찰하기에 매우 용이하다.
이 연구에서는 이전 연구에서 보고된 제부라린 처리 방식인 뿌리 흡수(root absorption) 방식이 아닌 종자를 제부라린 희석 용액에 침종(seed soaking)하는 방식을 사용하였다(Ma et al., 2016). 뿌리 흡수 방식은 분열조직세포(meristem cell)의 손상을 초래하여 뿌리 신장(root elongation)을 감소시키는 문제점이 있다(Cho et al., 2011). 이러한 이유로, 침종 처리 농도와 시간에 따른 뿌리의 신장과 체세포 분열지수(mitotic index)를 측정하여 제부라린이 분열조직세포에 미치는 영향을 확인하였다. 또한 체세포 분열 중기 염색체 구조(chromosome structure)를 관찰하여 염색체 이상(chromosome aberration)을 확인함으로써 보리의 작물학적 향상에 기여할 수 있는 염색체 수준의 기초 자료를 제공하고자 이 연구를 수행하였다.
재료 및 방법
식물재료 및 제부라린 처리
보리(Hordeum vulgare; 2n=2x=14)의 생장과 염색체에 미치는 제부라린(zebularine, Sigma-aldrich, USA)의 영향을 알아보기 위하여 국립식량과학원 작물육종과로부터 분양받은 국내 보리 품종인 흰찰쌀보리를 식물재료로 사용하였다. 제부라린의 농도는 dimethyl sulfoxide (DMSO, 200 μM)를 이용하여 용해한 다음, 증류수를 사용하여 최종 농도를 1.0, 2.5, 5.0, 및 10.0 μM로 조절하였다. 보리 종자의 충분한 제부라린의 흡수를 위하여 3일 동안 각 농도별로 4°C, 암조건에서 침종 처리하였다. 침종 처리 후, 증류수로 3번 세척한 종자를 농도 별로 페트리 접시(Petri-dish)에 옮겨 제부라린이 발아에 미치는 영향을 관찰하였다. 발아 조건은 25°C, 암조건으로 설정된 배양기(4 chamber incubator, JSR, Korea)에서 제부라린 침종처리에 따른 생장을 관찰하였다. 뿌리의 생장을 관찰한 후, 발아한 종자는 상토가 담긴 포트에 이식하여 30일 동안 상온에서 엽의 생장을 관찰하였다.
제부라린 처리를 통한 유사분열 중기염색체 관찰
제부라린 침종처리가 유사분열 중기염색체에 미치는 영향을 확인하기 위하여, 유사분열 중기염색체의 이상유무를 위상차 현미경을 이용하여 관찰하였다. 유사분열 중기염색체는 발아 4일 된 뿌리를 제부라린 농도별로 채취하여 1 mL의 증류수가 담긴 2 mL e-tube에 넣은 후 저온처리(0°C)하였다. 저온처리는 24시간 동안 수행하였으며, 저온처리 후 뿌리의 물기를 잘 제거하여 고정액(fixation solution, 3 ethanol : 1 acetic acid, v/v)에 처리하였다. 고정액 처리는 상온(25°C)에서 3일간 놓아두어 염색체를 충분히 고정시킨 후 냉장(4°C)에 관찰전까지 보관하였다. 위상차 현미경(phase-contrast microscope, Bx53F2, Olympus, Japan)을 통하여 유사분열 세포를 확인하였다(n=3).
통계 분석
모든 실험은 최소 3회 이상 반복을 두어 실시하였으며, 농도와 침종시간이 보리 초기의 뿌리, 초엽, 및 체세포 염색체에 미치는 영향을 ANOVA (Analysis of variance)를 사용하여 분석하였다(P<0.05). 침종시간별 농도에 따른 뿌리와 초엽의 길이의 차이는 DUNCAN의 다중 검정을 통하여 분석하였다(P<0.05). 통계처이는 통계프로그램 ‘R’을 이용하여 분석하였다(The R’ Project for Statistical Computing, https://www.r-project.org).
결과 및 고찰
제부라린이 보리 생장에 미치는 영향
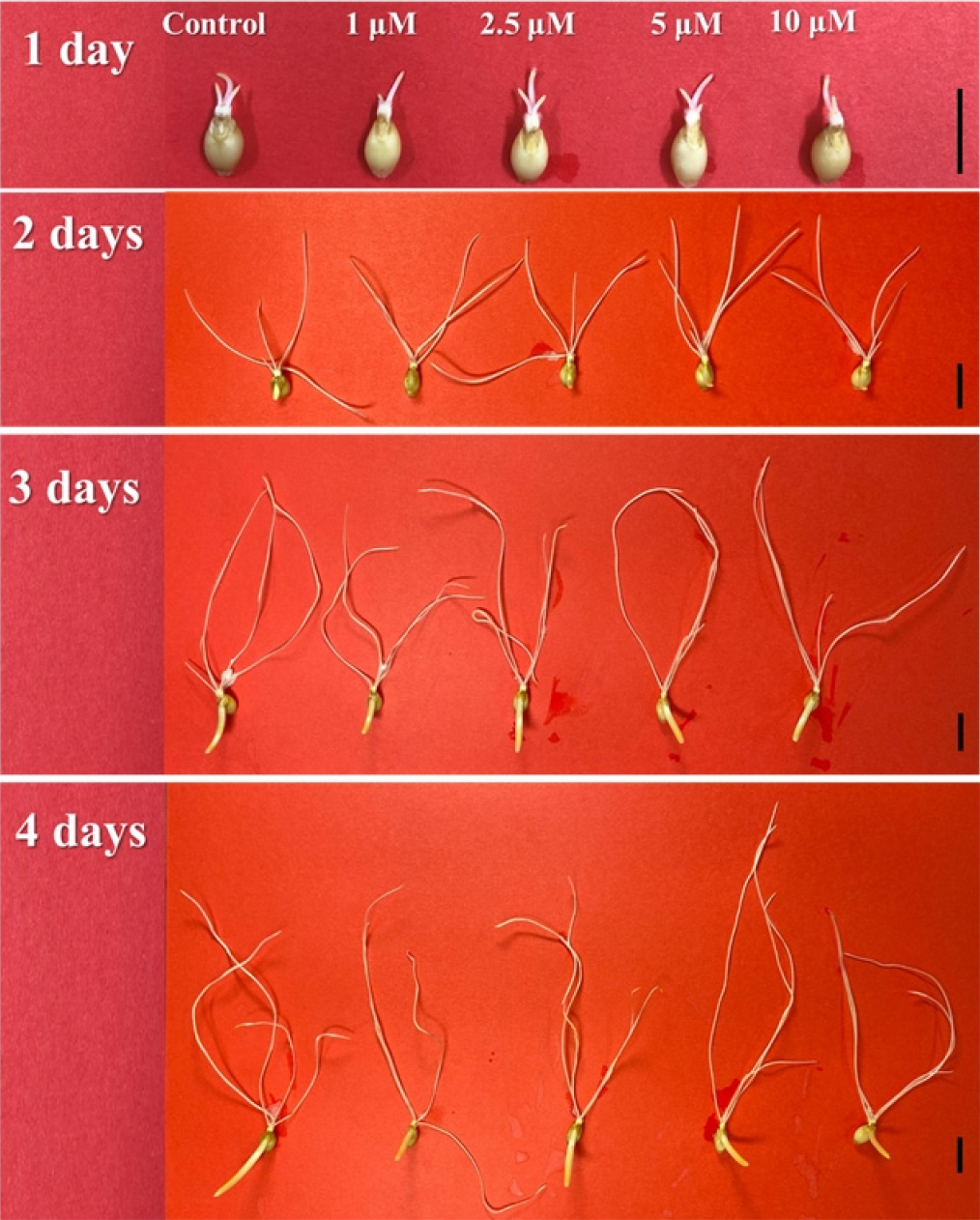
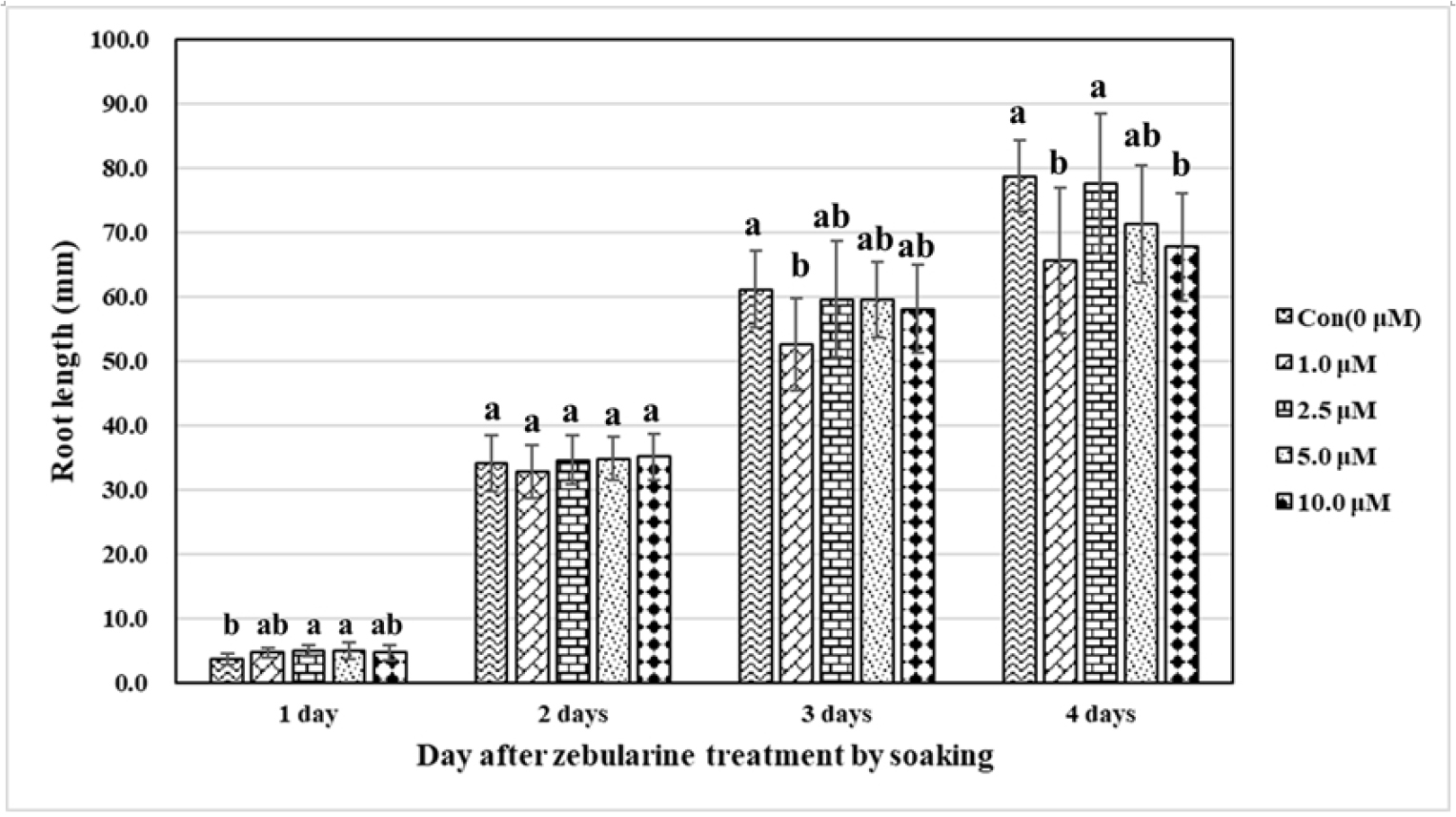
제부라린(zebularine) 침종처리의 영향을 관찰하기 위하여 보리의 뿌리 분열조직(meristem)의 분열정도에 따른 뿌리 신장(root elongation)을 측정하였다(Figs. 1 and 2). 제부라린 침종처리가 뿌리의 신장에 주는 영향을 보면, 처리시간(treatment time)과 농도(concentration), 그리고 처리시간과 농도의 상호작용(Treatment time × Concentration)이 뿌리의 신장에 영향을 주고 있는 것을 확인하였으며, 농도(0.5%)와 상호작용(0.2%)보다는 처리시간(99.3%)에 의하여 뿌리의 신장이 영향을 상대적으로 많이 받았다(Table 1).
Table 1.
Two-way analysis of variance for day, concentration, and the interaction between day and concentration according to zebularine treatment.
| Source of variation | DFa | SSb | MSc | F-valued |
| Treatment time | 3 | 131367 | 43789 | 1036.91*** |
| Concentration | 4 | 823 | 206 | 4.87*** |
| Treatment time × Concentration | 12 | 1022 | 85 | 2.02* |
| Residuals | 180 | 7601 | 42 |
침종 처리된 보리 종자의 초엽(coleoptile)을 기준으로 발아 하루 동안에 뿌리 신장은 대조구(control)에 비하여 제부라린 농도 2.5 μM와 5.0 μM에서 뿌리 신장이 빠른 것을 확인하였으며, 농도 1.0 μM과 10.0 μM은 유사한 뿌리 신장을 보였으며 대조구와는 차이를 보이지 않았다(Fig. 2). 발아 2일 후, 대조구와 각 농도별 뿌리 신장은 차이를 보이지 않았다. 발아 3일 후, 대조구의 뿌리 신장이 가장 활발했으며, 농도 2.5, 5.0, 및 10.0 μM의 뿌리 신장은 대조구와 유의한 차이를 보이지는 않았다. 농도 1.0 μM의 뿌리 신장은 대조구를 비롯하여 다른 농도보다 억제되는 것을 확인하였다. 발아 4일 후, 예측한 데로 대조구는 가장 활발한 뿌리 신장을 보였지만, 농도 1.0 μM와 10.0 μM의 뿌리 신장은 제부라린 침종처리에 의하여 많이 억제되는 것을 확인하였다. 농도 5.0 μM의 뿌리 신장도 발아 72시간 후의 뿌리 신장보다 대조구와 차이를 보였으나 그 차이가 통계학적으로 유의한 수준의 차이는 아니었다. 특이한 점은 농도 2.5 μM의 뿌리 신장은 다른 농도에 비하여 제부라린 침종처리에 의한 뿌리 신장의 억제 정도가 크기 않아 대조구와 차이를 보이지 않았다. 제부라린 흡수에 의한 뿌리의 신장은 제부라린의 고농도에서 처리 시간이 길수록 DNA 손상을 초래하여 뿌리 신장의 억제가 심한 것을 알 수 있었으나 (Cho et al., 2011), 이 연구에서는 상대적인 고농도(5.0 μM과 10.0 μM)제부라린 침종은 시간이 지남에 따라 뿌리 신장이 억제되는 것을 확인하였으나, 농도 1.0 μM보다 농도 2.5 μM에서 뿌리 신장 억제가 상대적으로 거의 일어나지 않아 뿌리의 길이가 대조구와 유의미한 차이를 보이지 않았다. 침종 처리에 따른 뿌리의 신장은 기존 처리 방식인 초엽(coleoptile)의 발생후 뿌리흡수처리 방식과 뿌리의 신장이 억제되는 시점에 확연한 차이가 확인되었다(Cho et al., 2011). 침종에 의해 건종자(dry seed)가 흡수한 수분에 의해 가수분해를 통해 저장양분을 필요영양소인 자당과 티미드 등을 발아에 이용할 때, 종자가 흡수한 제부라린이 필요영양소의 이용과 같이 발아하는 세포기관에 흡수되고 이 때 상대적으로 직접 뿌리가 흡수하는 제부라린 농도에 비하여 희석되기 때문에 제부라린에 의한 뿌리 신장의 억제가 뿌리흡수 처리 방식보다 늦게 나타남과 동시에 뿌리의 손상도 적은 것으로 예상할 수 있다.
보리 종자가 발아를 시작하면서, 제부라린이 초엽(coleoptile)에 미치는 영향을 관찰하였다(Figs. 3 and 4). 제부라린 침종 처리 후, 하루가 지난 시점에서 초엽은 육안으로 차이를 확인할 수 없었으며, 또한 측정할 정도의 생장을 보이지 않았다 (Fig. 1). 침종 처리 2일 후, 지난 시점에서 초엽의 신장에 차이를 보였다. 예측과는 다르게 무처리구보다 처리구에서 초엽의 빠른 신장을 확인하였으며, 심지어 제부라린 농도 10 μM에서 가장 초엽의 길이가 길었다. 이러한 현상은 침종 처리 3일 후에도 나타났으며, 침종 처리 4일 후에 무처리구와 처리구의 초엽의 길이에 차이가 없는 것을 확인하였다. 즉, 초엽의 길이가 차이가 없다는 것은 처리구에서 초엽의 신장에 억제가 일어난다는 것을 의미한다. 초생엽(primary leaf)이 나오고 3엽기를 시작하는 시기에 길이가 가장 긴 2엽의 길이를 측정한 결과(발아 30일 후), 예상과는 다르게 제부라린 농도 2.5 μM에서 가장 긴 엽 길이를 보였다. 뿐만 아니라, 제부라린 농도 10.0 μM를 제외한 제부라린 농도 1.0 μM과 5.0 μM도 대조구에 비하여 긴 길이를 보였다. 하지만 제부라린 농도 10.0 μM에서 초형(plant type)이 매우 작은 개체도 확인하였다. 제부라린이 식물의 생장초기 지상부의 생장에 가속화를 유발하고 이러한 현상이 등숙기 뿐만 아니라 황숙기에 이르기까지 생장 속도의 가속화가 이루어진다면 우리나라의 보리 재배환경에서 보리의 생장 속도를 조절할 수 있는 중요한 요소로 작용할 수 있을 것으로 생각한다. 하지만 제부라린이 엽의 출현과 신장에 미치는 영향에 대해서는 물질의 이동, 발달 세포가 뿌리와는 다르기 때문에 세포 수준에서 좀 더 면밀한 관찰이 필요할 것으로 생각한다.
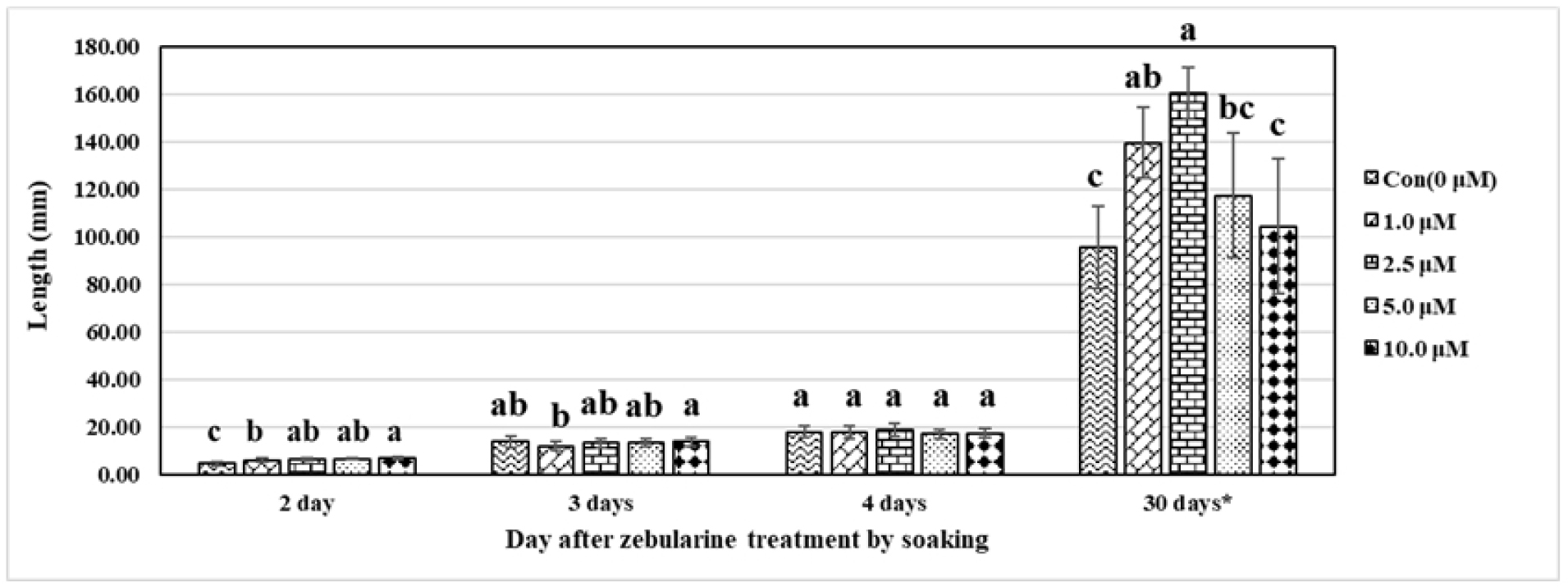
Fig. 3
Changes in shoot elongation according to the number of days after zebularine treatment by soaking and concentration of zebularine (n=10). Values followed by the same letters within each concentration in the same day are not significantly different at P≤0.05. * indicates that the numerical values were measured with the second leaf in each concentration (n=5).
체세포 분열 중기 염색체 이상
제부라린이 체세포 분열(mitosis)에 미치는 영향을 확인하기 위하여 중기 염색체(metaphase chromosome)를 확인하였다(Fig. 5). 제부라린 무처리구에서 보리의 염색체 수는 총 14개로 정상적인 염색체수가 확인되었다. 보리 염색체 5H와 6H는 각각 1쌍의 미소부수체(microsatellite)를 가지고 있다(Szakács et al., 2013). 이 연구에서도 보리 염색체는 4개의 미소부수체를 가지고 있는 것을 정확히 확인하였다(arrows in Fig. 5A). 밀의 염색체 길이는 특정 그룹의 염색체가 상대적으로 다른 그룹의 염색체보다 극히 크거나 작다(Gill et al., 1991). 보리의 염색체 길이는 육안으로는 식별할 수 없을 정도로 유사한 길이를 보였다(Fig. 5A). 따라서, 그 이외의 보리 염색체는 아세토카민 염색액으로 모든 염색체의 핵형을 확인하는 것에는 한계가 있었다. 특히, 1H와 4H의 염색체 크기는 매우 유사하여 C-밴딩이나 단순반복염기서열(simple sequence repeat, SSR)을 이용한 형광핵산혼성화(fluorescence in situ hybridization, FISH)를 이용한 확인이 필요하다(Linde-Laursen, 1978; Szakács et al., 2013). 무처리구에서 정상적인 보리 염색체를 기준으로 제부라린 10.0 μM 처리에서 보리 염색체의 염색체 이상을 확인하였다(Fig. 5B and Table 2). 대부분의 체세포에서는 무처리와 같은 정상적인 형태를 가진 보리 염색체를 확인하였다(20.0±1.63%). 반면, 제부라린에 의한 염색체 이상인 비정상 염색체(abnormal chromosome) 가 발생하는 것도 확인하였다(2.3±0.47%). 밀의 경우, 제부라린의 흡수에 의하여 밀 염색체가 절단되고 융합(fusion)되면서 고리 염색체(ring chromosome)와 3가 염색체(trivalent) 등 염색체 이상(chromosome aberration)이 확인되었다(Cho et al., 2011). 하지만 제부라린 처리에 따른 염색체 절단에 의한 이입(insertion)과 전사(translocation) 등 염색체 형태만으로 구분하기 어려운 염색체 이상은 형광핵산혼성화를 이용하여 좀 더 심도 있는 확인이 필요할 것으로 생각한다.
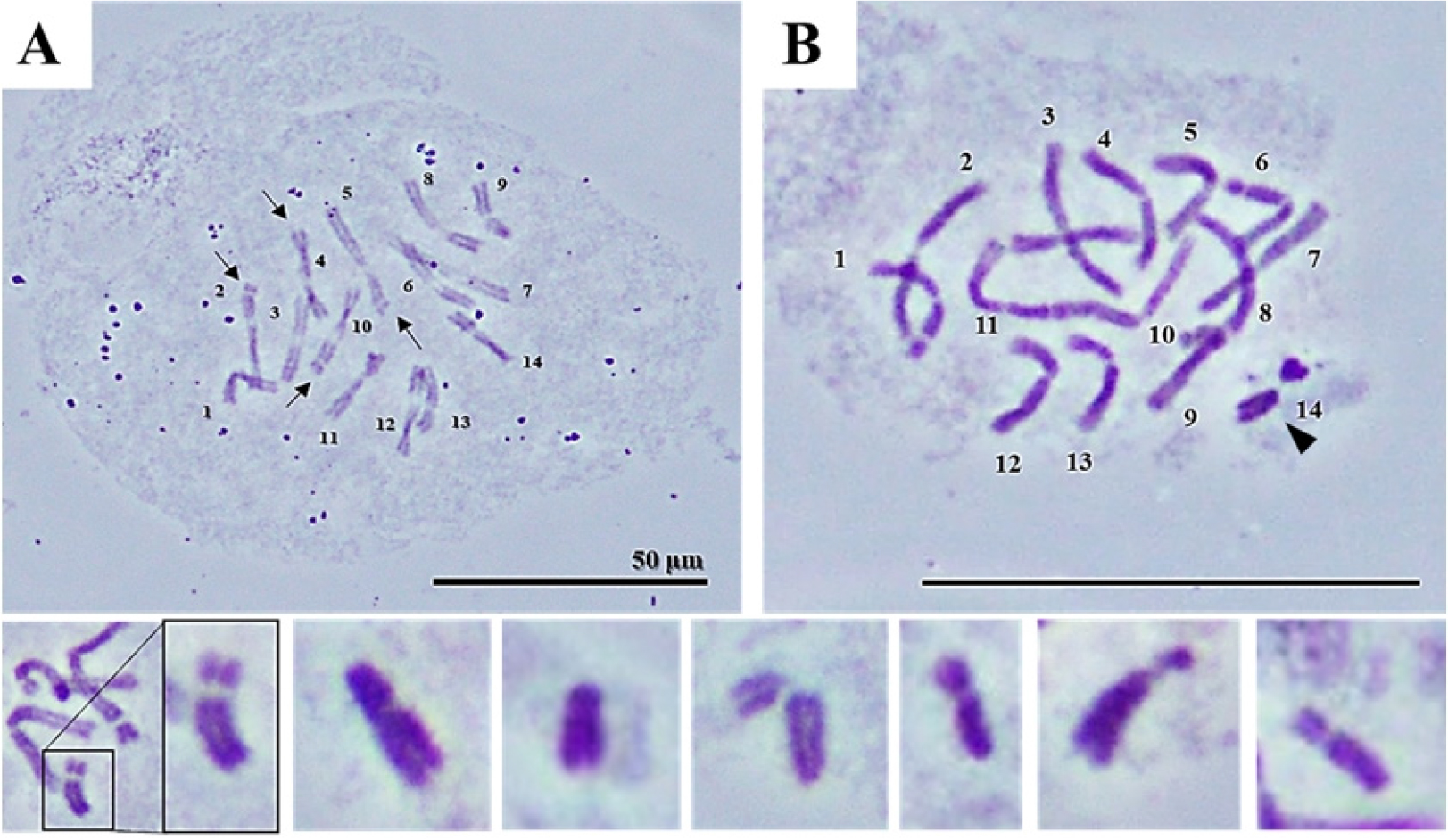
Fig. 5
Observation of chromosome aberration by zebularine treatment in metaphase. Barley chromosome without treatment (control) (A) and with zebularine treatment (B). Small quadrangles are examples of short chromosomes due to zebularine treatment. Arrows indicate microsatellites of barley chromosomes, and arrowheads indicate short chromosomes as chromosome aberrations. Scale bar=50 µm.
Table 2.
Frequency of chromosome aberration by zebularine treatment.
| No. of cells with short chromosomes | No. of metaphase cells without short chromosomes | Total counted cells |
| 2.3±0.47 | 20.0±1.63 | 100 |
보리의 경우, 제부라린 침종에 의한 비정상 염색체의 특징을 보면, 단순한 염색체 절단에 의한 염색체 단편과는 다소 형태의 차이가 있었다. 염색체의 형태에서 중요한 동원체(centromere)가 관찰되었으며, 동원체에 의하여 장완(long arm)과 단완(short arm)으로 구분되는 것을 확인하였다. 비정상 염색체의 장완과 단완은 특정 비율의 형태를 가지고 있지 않았다. 또한, 상대적으로 장완의 길이보다 단완의 길이에 변이가 더 심한 것을 확인하였다. 제부라린 침종에 의한 비정상 염색체의 출현과 같은 체세포의 이상에도 식물의 생장에는 큰 영향을 주지 않았으며, 오히려 제브라린의 침종의 의한 뿌리의 억제가 다른 농도에 비하여 심하지 않았던 2.5 μM에서 다른 농도와 심지어 무처리구보다 빠른 생장을 보였다. 따라서, 이 염색체가 염색체로써 기능을 가지고 있는지 그리고 세대를 거쳐 유전되는지는 제부라린이 처리된 식물에서 종자를 채종 후에 후대에서 검정이 가능하기 때문에 향후 후대에 대한 생식세포분열과 수정과정을 염색체 수준에서 확인할 필요가 있다고 생각한다.
적 요
이 연구는 보리의 뿌리와 엽의 출현과 신장 및 체세포 분열에서 중기 염색체를 관찰함으로써 시티딘 유사체인 제부라린이 보리의 초기 생장에 미치는 영향에 대하여 조사하였다. 제부라린은 염색체 절단을 유발하기 때문에 식물의 뿌리 신장을 억제하는 것으로 알려져 있다. 이 연구에서는 이러한 식물체에 미치는 손상을 줄이기 위하여 기존의 뿌리 흡수 처리 방식이 아닌 침종 처리 방식을 수행한 결과, 제부라린 농도 2.5 μM에서 대조구와 뿌리의 신장에 차이가 없었으며, 동일 농도에서 엽의 신장력은 대조구보다 높았다. 체세포 분열에서 중기 염색체를 관찰한 결과, 대부분의 세포는 정상 형태의 염색체를 가지고 있는 것으로 확인되었다. 특이한 점은 약 2.0%에 상응하는 세포에서 정상 형태의 염색체보다 크기가 매우 작은 비정상 염색체가 확인되었으며, 이 비정상 염색체의 형태는 동원체를 가지고 있으나 불규칙한 형태를 가지고 있는 것으로 확인되었다. 이 비정상 염색체의 염색체 능력과 유전력에 대해서는 좀 더 심도 있는 연구가 필요할 것으로 생각한다.