서 론
우리나라에서 간척사업은 주로 농지 확보를 위해 이루어졌으며 최근에는 산업용지, 생태·환경용지, 방조제 용지 등으로 이용도가 확대되고 있지만 아직도 농지로 이용되는 면적이 가장 많다. 최근에 간척된 새만금의 경우에도 전체 면적의 42%인 12,180 ha의 토지가 농업용지로 사용될 예정이다(Kim et al., 2012). 그러나 새만금 간척지의 경우, 토양 염농도가 0.1~2.5%로 큰 변이를 보이기 때문에 내염성이 없는 일반작물의 안정적인 재배는 불가능한 상황이다 (Kwon et al., 2016). 따라서 염농도가 높은 초기 간척지 토양에서 식물재배가 가능하려면 내염성이 높은 식물이 필요하며, 이를 위해서는 고염 조건에서도 생존이 가능한 염생식물 중 재배 목적에 맞는 식물을 선발하는 것이 중요하다.
식물의 염 스트레스는 과도한 염류 집적에 의해 토양 내 삼투압이 증가하고 이에 따라 수분 흡수가 저해되어 나타나는 수분 결핍 현상과 특정 이온의 비정상적인 흡수에 의한 이온 특이적 효과와 이 두 가지의 원인의 복합적인 작용에 의한 현상으로 설명되고 있다. 염분이 높은 토양에서 자라는 식물이 낮은 수분 포텐셜을 나타내는 토양으로부터 수분을 흡수하기 위해서는 토양보다 더 낮은 수분 포텐셜을 가져야 하므로 내부적으로 유기용질이나 무기용질 등을 축적한다(Lee et al., 1999). 염 스트레스에 대한 반응으로 다수의 염생식물들은 삼투보호제로 알려진 betaine 화합물, proline 같은 아미노산, manitol, sorbitol 및 arabitol등과 같은 polyol 및 sugar 등과 같은 저분자 유기화합물들을 세포내에 축적한다(Flowers et al., 1977; Rhodes & Hamson 1993; McNeil et al., 1999). 삼투보호제 가운데 proline과 betain 등은 가용성 유기질소화합물이며, 많은 내염성 식물들은 여러 종류의 가용성 질소화합물들을 고농도로 함유한다 (Lea & Ireland 1999). 이중에서도 proline은 식물이 염 스트레스를 받을 때 증가하는 아미노산의 일종으로 많은 연구자들에 의해 구명되었는데(Kim et al., 2004) 일반적으로 해홍나물, 나문재 등의 염생식물의 경우 염에 대한 체내 방어기작으로 proline합성이 증가하여 수분포텐셜을 조절하는 osmoticum으로 작용하는 것으로 알려져 있다(Binzel et al., 1985). 염생식물은 토양 염농도가 높은 토양에서도 잘 적응하고 생장하며, 염 스트레스 환경과 관련된 형태적 특성과 식물체 내의 염분을 제거하기 위한 생리적 기작을 가지고 있다(Waisel, 1972). 이러한 염생식물 중에서 나문재는 명아주과(Chenopodiaceae)에 속하는 1년생 초본으로 일본, 중국 등지의 바닷가에 널리 분포하며, 우리나라에서는 서해안이나 도서지방, 남해안, 간척지 등의 해변, 해안사구, 내륙의 염지, 폐 염전 등에 주로 서식하는 염생식물이다.
나문재에 대한 연구는 식물 군락이나 분포 특성에 대한 연구, 그리고 염농도에 대한 식물체의 반응에 대한 연구가 주로 이루어졌고, 내염성에 관한 생리기작에 관해서는 자세히 규명되지 않은 실정이다(Breckle, 1990; Osmond et al., 1980). 본 연구는 염 농도에 따른 나문재의 생장, 무기이온과 아미노산 함량, 그리고 광합성 효율을 평가하여 염농도에 따른 생장 및 생리적 특성을 검토하고자 수행하였다.
재료 및 방법
본 연구에 사용된 나문재 종자는 2015년 12월에 새만금 간척지에 자생하는 식물체로부터 채종하여, 종자수분함량이 10~12% 정도가 되도록 실험실 내의 상온 조건에서 건조하여 4°C에서 냉장보관 하여 실험에 사용하였다.
식물체 재배는 Table 1의 Hogland 용액을 넣은 배양액을 이용하여 수경재배 하였다(Jeong et al., 2017). 식물체는 25°C의 식물생장상에서 2주간 발아와 육묘한 후에 총 14개의 구멍이 8 cm x 10 cm 간격으로 뚫려있는 스트로폼 양액 정식판의 각 구멍에 식물체 1개체씩을 이식하여 재배하였다. 수경재배기에 이식한 식물체는 1주일동안 양액에 적응시킨 후, NaCl을 이용하여 배양액의 염농도를 0 mM, 50 mM, 100 mM, 200 mM, 300 mM, 400 mM의 6개 농도로 조절하였다. 염농도를 조절한 배양액은 1주일 간격으로 교체하면서, 8주동안 재배하였다. 재배기간 동안 온실의 평균 온도는 19.9°C이었고, 온실 내 수경재배기는 염농도별 3반복으로 완전임의로 배치하였다. 수경재배기 1기에서 식물체는 10개체를 조사하여 초장, 분지수, 건물중을 측정하였다.
Table 1. Ingredients of Hogland’s solution.
| Macronutrients | N | P | K | Ca | Mg |
| ----- me/L ----- | |||||
| Concentration | 12 | 3 | 6 | 7 | 4 |
식물체의 무기이온 분석은 식량작물환경 분석법 핸드북을 기준으로 분석하였다(NICS, 2014). 8주동안 온실에서 재배한 식물체를 70°C에서 2일 동안 건조시켜 분쇄하였다. 식물체의 무기성분 분석의 전처리로 유기물 분해과정은 습식분해법 중 과산화수소-황산 분해법을 이용하였다. 분쇄한 식물체 0.5 g 시료에 황산(H2SO4)을 5 mL를 가한 다음 실온에서 하루 동안 반응시켰다. 반응시킨 시료에 과산화수소(H2O2)를 0.5 mL씩 넣으며 분해액이 무색투명해질 때까지 낮은 온도부터 점차 고온으로 가열해주었다. 분해가 완료된 시료를 여과지로 여과시켜 준 후 200배액의 분석 시료액을 만들었다. 무기성분 Ca2+, K+, Mg2+ 및 Na+ 함량은 ICP-OES (Varian Vistar-MPX, USA)으로 측정하였으며, 무기성분에 따라 K-766.490 nm, Ca-396.847 nm, Mg-279.553 nm, Na- 589.592 nm 파장에서 측정하였다(Jeon & Park, 2011).
측정 후 각 무기이온의 농도는 아래 계산식으로 산출하였다.
$$K_2O(\%)=\frac{측\mathrm{정값}(mgL^{-1})\times\mathrm 전처\mathrm{리시료액의}최\mathrm{종부}피}{\mathrm 전처\mathrm 리(\mathrm{습식분}해)\mathrm{된식물}체\mathrm{무게}(g)\times1.20\times10,000}$$ $$CaO(\%)=\frac{측{\mathrm{정값}(mgL^{-1})\times\mathrm 전}처\mathrm{리시료액의}최\mathrm{종부}피}{\mathrm 전처\mathrm 리(\mathrm{습식분}해)\mathrm{된식물}체\mathrm{무게}(g)\times1.40\times10,000}$$ $$MgO(\%)=\frac{측\mathrm{정값}(mgL^{-1})\times\mathrm 전처\mathrm{리시료액의}최\mathrm{종부}피}{\mathrm 전처\mathrm 리(\mathrm{습식분}해)\mathrm{된식물}체\mathrm{무게}(g)\times1.66\times10,000}$$ $$Na_2O(\%)=\frac{측\mathrm{정값}(mgL^{-1})\times\mathrm 전처\mathrm{리시료액의}최\mathrm{종부}피}{\mathrm 전처\mathrm 리(\mathrm{습식분}해)\mathrm{된식물}체\mathrm{무게}(g)\times1.35\times10,000}$$아미노산 분석을 위한 시료는 동결건조기로 동결 건조 후 Auto mill (Tokken Inc., Japan)을 이용하여 분쇄하여 사용하였다. 반복별 시료 1 g에 0.1% Formic acid 10 ml 첨가한 후 4°C에서 13,000 rpm으로 10분간 원심분리 하였다. 상등액 100 ㎕에 ethanol 900 ㎕를 가한 후 PVDR필터로 여과하여 Waters ACQUITY UPLC에 3 ㎕를 주입하여 분석하였다. 컴럼은 IMTAKA Intrada Amino Acid (50 x 2 mm, Pure spherical silica / unique stationary phase)를 이용하였다.
광합성 효율은 엽록소 형광측정기(OS-30p)를 이용하였으며, 측정 전 나문재의 잎을 20분동안 암처리하여 암조건에 적응된 잎에 엽록소 형광측정기에 설치된 적생광을 조사하여 Fv/Fm값을 측정하였다.
결과 및 고찰
나문재의 염농도에 따른 생장량은 Fig. 1과 같다. 분지수, 초장, 건물중은 모두 50 mM의 염농도에서 가장 높게 나타났으며, 나문재의 분지수, 초장, 건물중 등 생육량은 염농도가 높아질 수록 감소하는 경향을 보였다. 그러나 염농도에 따른 생장량 차이는 크지 않아 0 mM~400 mM의 넓은 범위의 염농도에서도 나문재는 정상적인 생육이 가능한 식물로 판단된다. 이러한 결과는 나문재의 염농도에 따른 생육특성에 대한 Kwon et al. (2016)의 보고와 비슷한 경향이었다.
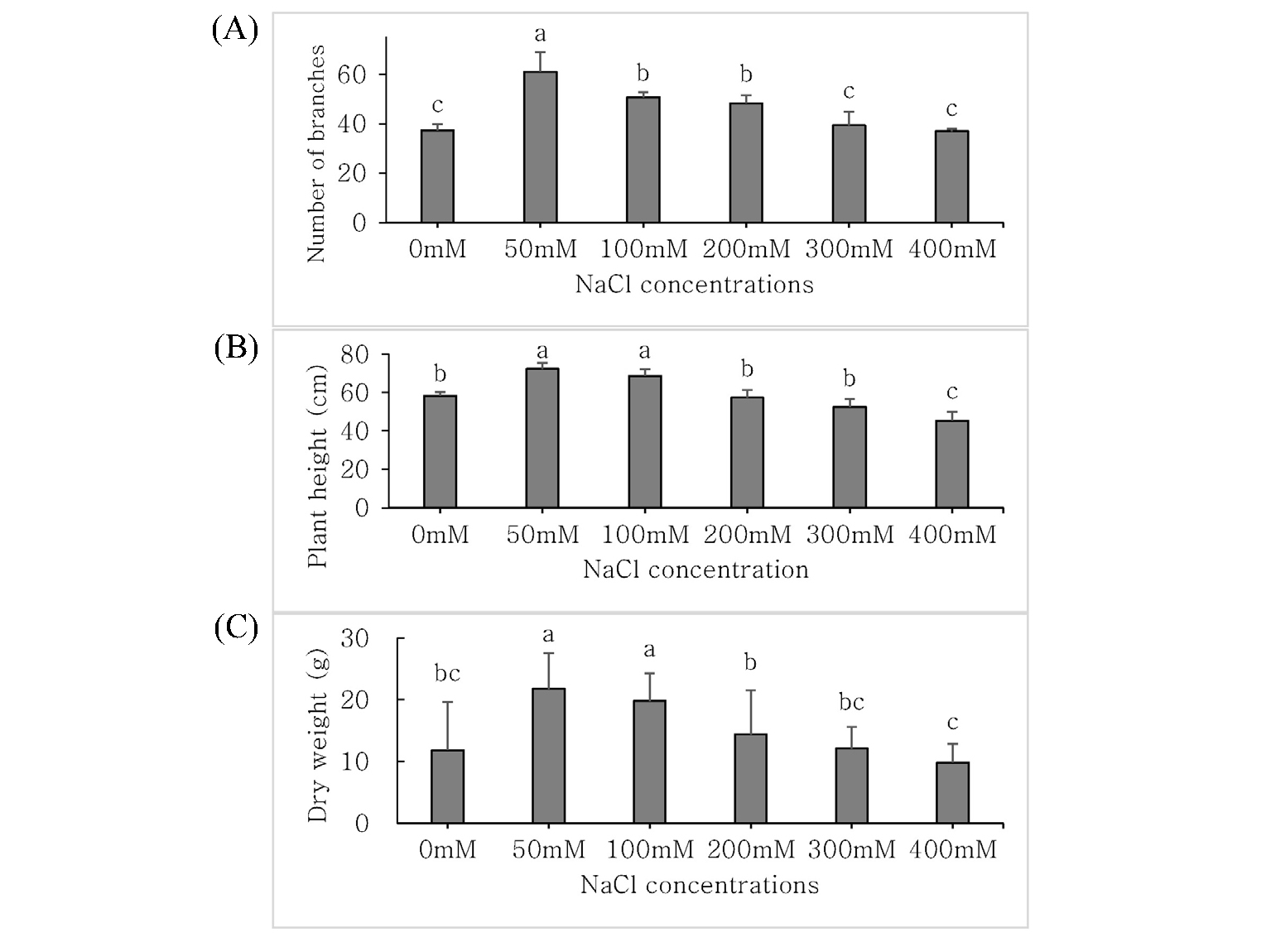
Fig. 1.
Number of branches (A), Plant height (B), and Dry weight (C) of Suaeda glauca under different NaCl concentrations (mM). Within the same column, means followed by the same small letter are not significantly different, as determined by DMRT at α = 0.05. Vertical bars indicate standard deviations.
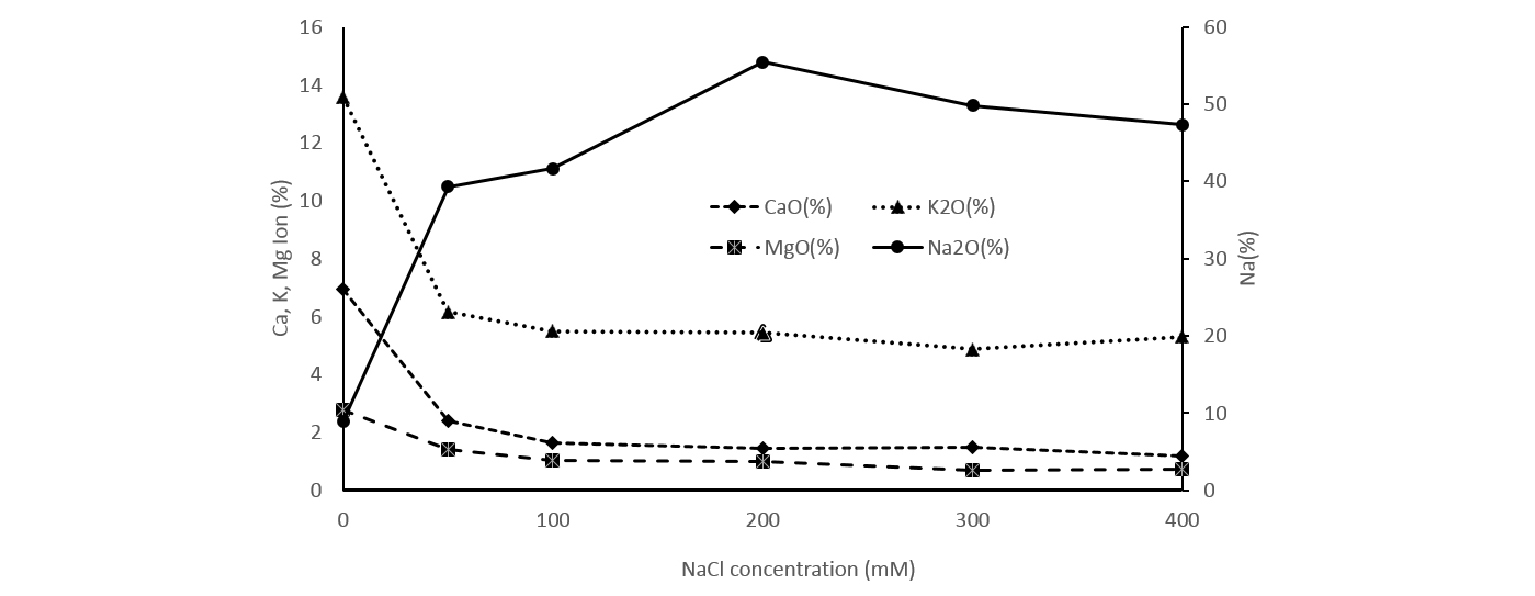
염농도에 따른 식물체 전체에 함유된 무기이온 함량은 Fig. 2와 같았다. 염농도가 높아질수록 Na 이온의 함량은 증가하고, K, Ca, Ma 이온의 함량은 감소하는 경향을 보였다. Na이온은 염농도가 200 mM까지 증가할수록 식물체내 함량이 크게 증가하였으며, 200 mM이상에서는 약간 감소하였다. K, Ca, Ma 이온은 0~100 mM로 범위에서 염농도가 증가할 때 급격히 감소하였고, 100-400 mM의 범위에서는 염농도에 따른 함량의 변화가 크지 않았다. 갯질경, 갯개미자리 등의 다른 염생식물에서도 나문재와 유사하게 염농도에 따른 무기이온이 변화되며, 염생식물에서 NaCl의 높은 흡수가 다른 무기 성분의 구성과 세포 대사와 신호 전달 체계에 영향을 미치는데 이러한 변화는 염 스트레스에 대한 식물체의 방어 기작으로 이해되고 있다(Baxter, 2010; Jeong et al., 2017; Lee et al., 2016; Zhu, 2003).
나문재의 염농도에 따른 무기함량의 변화를 식물체의 뿌리, 줄기, 잎으로 구분하여 측정한 결과는 Table 2와 같다. 식물체의 무기이온 함량은 식물체 부위별로 함량이 다르게 나타났다. Na과 Mg 이온의 함량은 잎 > 뿌리 > 줄기의 순이었고, Ca이온은 잎 > 줄기> 뿌리 순이었으며, K이온은 줄기 > 뿌리 > 잎 순으로 나타났다. 특히, Na이온은 잎 조직의 함량이 줄기나 뿌리 조직에 비해 매우 높게 나타났는데, 이러한 결과는 염생식물의 Na이온 함량이 지하부보다 지상부에서 더 높다는 Rozentsvet et al. (2017)의 보고와 일치하였다.
Table 2. Ion contents in leaves, stem, and root of Suaeda glauca depending on NaCl concentration. Within the same column in each plant part, means followed by the same small letter are not significantly different by DMRT at α = 0.05.
잎 조직에서 Ca이온 함량은 0 mM에서 3.1%이었으나 50~400 mM에서는 염농도에 관계없이 0.5-0.6%이었다. 잎의 K이온 함량은 0 mM에서 5.0%였으나 50 mM에서 2.6%로 낮아졌고 염농도가 증가할수록 K이온 함량은 계속 낮아져서 400 mM에서 1.2%를 보였다. 잎의 Mg이온 함량도 K 이온과 같은 경향으로 0 mM에서 함량이 가장 높았고 염농도가 증가하면서 감소하는 경향이었다. 잎에서의 Na이온의 함량은 0 mM에서 6.3%였으나 염농도가 증가하면서 농도가 증가하여 400 mM에서 23.4%의 함량을 보였다.
줄기에서 Ca이온 함량은 0 mM에서 2.6%이었으나 50~400 mM에서 0.36-0.6%를 보였고, K이온 함량은 0 mM에서 5.5%였으나 50 mM에서 2.0%로 낮아졌고 염농도가 증가할수록 낮아지는 경향을 보였다. 줄기에서Mg 이온 함량은 0 mM에서 0.5%였으나 염농도가 증가하면서 점진적으로 감소하는 경향이었다. 줄기에서 Na이온의 함량은 0 mM에서 1.7%였으나 염농도가 증가하면서 농도가 증가하여 300 mM에서 11.4%까지 증가하였다.
뿌리에서 Ca이온 함량은 0 mM에서 1.3%, 50 mM에서 1.2%, 100 mM에서 0.8%로 염농도가 증가하면서 점진적으로 감소하는 경향을 보였다. 뿌리에서K이온 함량은 0 mM에서 3.1%였으나 50 mM 이상의 염농도에서 약 50% 정도 낮아졌으나 염농도에 따른 일정한 경향은 보이지 않았다. 뿌리에서 Mg이온 함량은 염농도가 증가하면서 점진적으로 감소하는 경향이었다. 뿌리에서 Na이온 함량은 0 mM에서 0.9%였으나 염농도가 증가하면서 농도가 증가하여 400 mM에서 15.2%까지 증가하였다.
일반적으로 염 스트레스를 받는 식물의 경우 Na이온이 체내에 축적되어 세포내 원형질의 삼투퍼텐셜 및 대사활성이 감소되어 식물의 생육에 저해를 받게 된다(Greenway & Munns, 1980). 그러나 염생식물의 경우, 비교적 높은 Na이온 조건하에서도 K이온의 선택적 흡수력이 높고 Na이온에 대해 길항적으로 삼투압을 유지 시키며(Palmgren, 1990), 염농도가 높아져도 세포 내 이온균형의 항상성이 유지된다고 보고되었다(Lee et al., 1999).
나문재의 염농도에 따른 유리 아미노산 함량을 식물체 전체를 대상으로 조사한 결과는 Table 3과 같다. Glycine 등16종의 아미노산 함량은 염농도에 따라 다양한 변이를 보였으나, 공통적으로 50 mM농도에서 가장 낮게 나타났다. 아미노산 중 Gly, Ala, Ser, Val, Thr, Glu, Asp 은 0 mM에서 함량이 가장 많았으며, Ile, CyS, Arg은 100 mM, Lys, Leu, Met, His, Phe는300 mM, 그리고 Tyr은 400 mM에서 가장 높은 함량을 보였다. 염생식물을 포함한 대부분의 식물은 염분 및 가뭄 스트레스에 반응하여 아미노산과 amides를 체내에 대량으로 축적하며(Nasir et al., 2010), 이러한 아미노산은 식물의 삼투압 조절, free radical 소거 및 단백질과 세포막의 특성 유지에 관여 하는 것으로 알려져 있다(Flowers & Hall, 1978; Gilbert et al., 1998; Misra & Gupta, 2005). 이 실험에서 나문재의 유리 아미노산 함량이 가장 낮았던 50 mM의 염농도는 나문재의 생육이 가장 왕성했던 염농도로, 이 식물이 해안의 사구지를 중심으로 서식하는 것을 고려할 때 오랜 시간의 진화과정을 거쳐 50 mM 정도의 염농도에서 생리대사가 최적화되었기 때문인 것으로 추측된다.
Table 3. Amino acid content (μg/g) of Suaeda glauca under different NaCl concentrations. Within the same raw, means followed by the same letter are not significantly different, as determined by DMRT at α = 0.05.
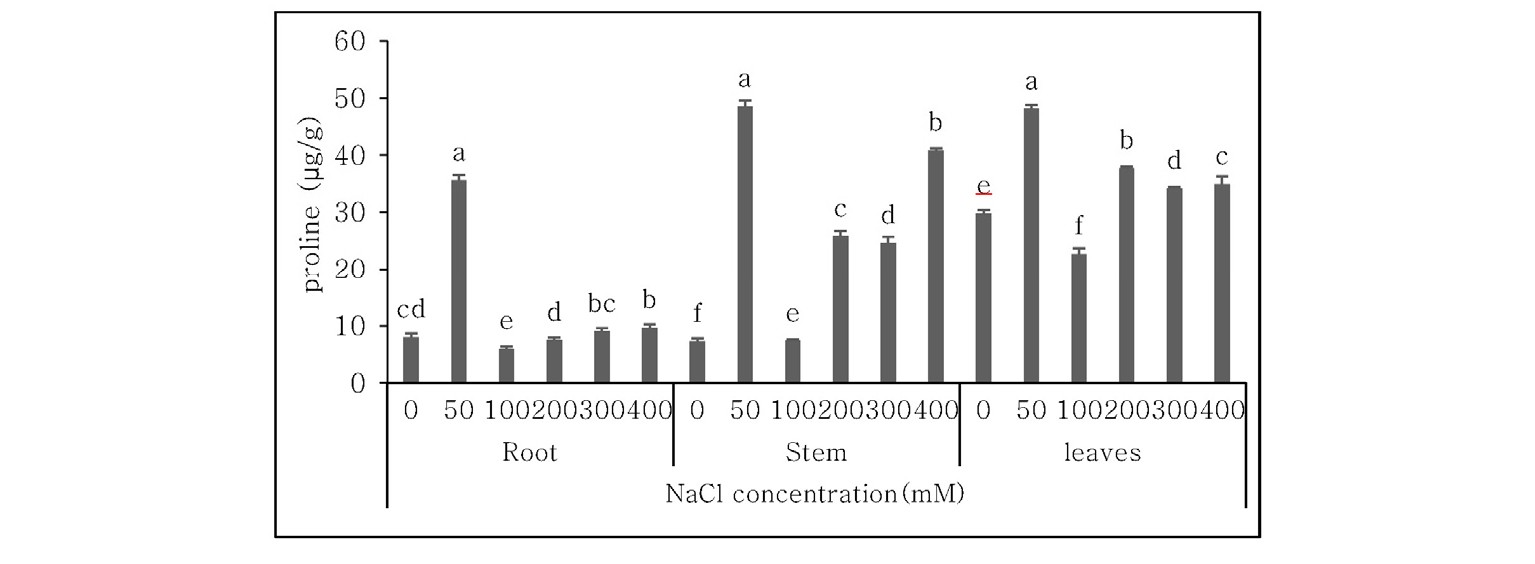
아미노산 중 proline의 염농도와 식물체 부위별 함량은 Fig. 3과 같다. 앞에서 언급한 16종의 아미노산과는 정반대로 proline은 식물체의 뿌리, 잎, 줄기에서 모두 50 mM에서 가장 높은 함량을 보였으며, 특히 뿌리에서의 proline 함량은 다른 염농도에서 보다 상대적으로 매우 높게 나타났다. 나문재의 뿌리와 줄기에서 50 mM을 제외한 0~400 mM의 염농도 범위에서는 염농도가 증가함에 따라 proline함량이 증가하는 경향을 보였다. Proline은 식물체 내의 세포나 조직 내에서 삼투압을 조절하는 osmolyte로써 작용하는 것으로 잘 알려져 있으며(Misra & Gupta, 2005; Rai, 2002), proline이 50 mM의 염농도에서 높은 함량을 보이는 것도 위에서 언급하였듯이 50 mM 정도의 서식처에서 오랜 기간 동안 적응한 결과로 생각된다.
식물체의 잎을 어두운 곳에서 암 적응시키면 엽록소 전자 전달계의 전자전달체가 산화상태에 있으며(Fo, 초기형광), 이 잎에 광포화점 이상의 강한 빛을 비추면 광화학 반응이 진행되면서 최대형광(Fm)을 보인다. 이 때, Fm - Fo는 최대변이 형광(Fv)이며, Fm에 대한 Fv의 비가 광화학반응의 최대양자수율(Fv/Fm)을 의미하며, 이 값은 식물의 광합성 활성에 대한 지표로 사용된다. 염농도 별로 측정한 식물체의 Fv/Fm값은 Table 4와 같다. Fv/Fm 값은 0 mM에서 0.77, 50 mM에서 0.79, 100 mM에서 0.78, 200 mM에서 0.74, 300 mM에서 0.73, 그리고 400 mM에서 0.74로 50 mM에서 가장 높게 나타났고, 염농도가 증가하면서 감소하는 경향이었으나 통계적 유의성은 없었다. 위의 결과에서 알 수 있듯이 나문재의 경우 200~400 mM의 높은 염농도에서도 광합성 효율은 최적 염농도 조건과 차이가 크지 않았다. Kim et al. (2007)의 보고에서도 퉁퉁마디, 해홍나물, 나문재에서 염농도가 높을 수록 Fv/Fm값이 다소 감소하지만 감소량은 미미한 수준이며 염농도와 관계없이 왕성한 광합성이 일어난다고 하였으나(Kim et al., 2007), 본 실험의 결과에서 염농도에 따른 8주간의 생육량의 차이가 유의했던 것을 감안하면 광합성 효율의 미세한 차이가 생육기간동안 지속적으로 영향을 미쳐 전체적인 생육량의 차이를 가져올 수 있었던 것으로 추측된다.
Table 4. Photosynthesis efficency (Fv/Fm value) of Suaeda glauca under different NaCl conditions.
| NaCl concentration (mM) | |||||
| 0 | 50 | 100 | 200 | 300 | 400 |
| 0.77±0.00 | 0.79±0.01 | 0.78±0.01 | 0.74±0.01 | 0.73±0.03 | 0.74±0.01 |
적 요
본 연구는 염 농도 별 나문재의 생장과 식물체 내의 무기이온과 아미노산 함량, 광합성 효율 등을 조사하여 염농도에 따른 나문재의 생리적 특성을 구명하고자 실시하였다. 나문재의 초장, 분지수, 건물중을 조사하였을 때, 50 mM에서 최적의 생육 상태를 보였고 50~100 mM의 염농도 범위에서 생육이 양호하였다. 식물체 내 무기이온의 함량은 염농도가 높을수록 Na 이온의 함량은 증가하였고, K, Ca, Mg 이온의 함량은 감소하였다. 식물체 부위별 무기이온의 함량은 Na 이온의 함량은 지하부보다 지상부에서 더 높게 나타났다. 염농도에 따른 식물체의 유리아미노산 함량을 보면, proline을 제외한 glycine 등의 16종의 아미노산은 공통적으로 생육에 최적 염농도인 50 mM에서 함량이 가장 낮게 나타났으며, proline은 정반대로 50 mM에서 현저히 높은 함량을 보였다. 염농도에 따른 광합성 효율은 50 mM에서 가장 높았으나 400 mM의 높은 염농도에서도 광합성효율의 저하는 크지 않았다. 결론적으로, 나문재의 생육에 최적 염농도는 50 mM이었지만, 염농도 변화에 따른 식물체 내의 무기이온, proline 등의 아미노산 함량의 변화, 그리고 고염조건에서도 광합성 효율을 유지할 수 있는 생리적 특성으로 0~400 mM의 넓은 범위의 염농도에서도 생육이 가능하여, 염농도의 변이가 큰 신간척지에 적합한 염생식물로 판단된다.