서 론
재료 및 방법
시험재료
Crude fat 함량 분석
Fatty acid composition 분석
Amino acid 분석
Phytosterol 분석
통계분석
결과 및 고찰
옥수수 이삭이 성숙하는 동안 속대와 종실의 crude fat과 fatty acid의 변화
옥수수 이삭이 성숙하는 동안 속대와 종실의 phytosterol 함량 변화
옥수수 이삭 등숙 기간 동안의 속대와 종실의 amino acid 함량 변화
옥수수 속대와 종실의 생리적 성숙 단계의 phytosterol, crude fat, fatty acid, amino acid 구성에 따른 분류
적 요
서 론
옥수수(Zea may L.)는 쌀, 밀과 함께 세계 3대 작물 중 하나이며 전 세계에서 가장 곡물 생산성이 높은 작물로, 2023년 세계 옥수수 생산량은 11억 5,449만 톤으로 쌀(5억 579만 톤)과 밀(7억 8,065 만 톤)의 생산량을 넘어선다(KREI, 2023). 건조 옥수수 곡물 1 톤을 생산할 때 약 180–200 kg의 옥수수 속대가 생산되므로, 2023년 약 2억 780만 톤 이상의 옥수수 속대가 생산될 것으로 추정된다(Kanengoni et al., 2015). 옥수수 곡물 생산량이 증가함에 따라 부산물인 속대의 생산량도 증가하고 있지만 대부분 폐기물로 간주되고 있으며 이를 활용하기 위한 노력은 부족하다(Jansen, 2012). 그러나 최근 연구에서 옥수수 속대에 cholesterol 저하, 항산화, 항염증, 항암 효과가 우수한 phytosterol이 풍부하게 함유되어 있는 것이 확인되었다(Bae et al., 2022). 따라서 옥수수 속대의 잠재적 활용 가능성 탐색을 통해 폐기물을 최소화할 뿐만 아니라 생리활성 화합물의 추가 공급원을 확보할 수 있다.
Phytosterol은 식물 세포벽과 세포막의 유동성, 투과성, 막 관련 대사 과정을 조절하는 중요한 구성요소이며 동시에 다양한 발달 경로를 조율하는 신호 분자로 작용한다(Boutté & Jaillais, 2020). 현재까지 확인된 plant sterol은 250여 종으로, C-4 위치의 methyl group의 수에 따라 simple sterol, 4-desmethylsterol, 4,4-dimethylsterol, 4-monomethylsterol로 분류된다(Verleyen et al., 2002). 가장 널리 분포된 plant sterol은 β-sitosterol, campesterol, stigmasterol을 포함하는 4-desmethylsterol로 육상 식물과 수생 식물 모두에서 풍부하게 발견된다. 일반적으로 견과류나 유채와 같은 유지 종자는 total phytosterol 함량이 높으며, 다양한 식물성 기름 중에서도 옥수수(Zea may L.), 대두(Glycine max (L.) Merr.), 밀(Triticum aestivum L.)에서 추출한 식물성 기름은 중요한 sterol 공급원이다(Normén et al., 2007). 곡물은 유지작물에 비해 plant sterol의 함량이 낮지만, 하루 plant sterol 섭취량의 최대 40%를 곡물로 섭취하고 있기 때문에 곡물은 영양학적으로 중요한 역할을 한다(Moreau et al., 2018).
Phytosterol은 cholesterol 저하 효과에 대해 널리 연구되어 온 식물 유래 sterol로 다양한 연구에 따르면 phytosterol은 소장에서 cholesterol 흡수를 감소시켜 혈중 콜레스테롤 수치를 낮추고, 장 내강에서 cholesterol의 배출을 촉진시킨다(Poli et al., 2021). 또한 최근 연구에서 옥수수 속대에 종실보다 많은 양의 phytosterol이 함유되어 있고, 속대가 plant sterol의 잠재적 공급원이 될 수 있음을 확인하였다(Bae et al., 2022). 그러나 옥수수가 성숙하는 동안 옥수수 속대 성분의 변화에 대해서는 알려진 바가 거의 없다. 옥수수 속대는 이삭의 중앙 목질 부분인 속대와 속대를 둘러싸고 있는 껍질로 구성된 복합 구조물로 45%–55%의 cellulose, 25%–35%의 hemicellulose, 20%–30%의 lignin으로 구성되며, 이삭이 성숙함에 따라 속대와 종실은 수분 함량과 세포벽 구조 구성에 다양한 변화를 보인다(Kanengoni et al., 2015). 이러한 변화는 옥수수 속대의 phytosterol과 기타 생리 활성 화합물의 농도에 영향을 미칠 수 있다. 따라서 옥수수 이삭 성숙 중 속대의 구성 변화를 탐색하는 것은 phytosterol을 활용하기 위한 최적 시기를 결정하는 데 필수적이다.
옥수수는 전분, 감미료, 옥수수유, 음료, 산업용 알코올, 바이오 연료 등 다양한 식품 및 산업용 제품으로 이용되고 있다(Yu & Moon, 2022). 사일리지 옥수수는 식물체 전체를 가축사료로 활용하지만 종실용 옥수수는 종실만을 식품 및 산업용으로 활용한다. 옥수수 종실을 이용하는 식품 및 산업 분야가 커질수록 종실을 제외한 농업 부산물을 활용할 수 있는 연구의 필요성이 커지고 있다. 광평옥은 국내에서 널리 보급되어 농가에서 재배되고 있는 대표적인 사일리지 및 종실용 옥수수이다. 따라서 본 연구에서는 국내에서 널리 재배되고 있는 옥수수인 광평옥 이삭의 성숙 과정에 따른 속대와 종실의 성분 변화를 phytosterol 함량에 초점을 맞추어 분석하고, phytosterol 및 기타 생리 활성 화합물의 공급원으로서 옥수수 속대의 잠재적 활용에 대한 가능성을 탐색하고자 한다.
재료 및 방법
시험재료
본 연구는 국립식량과학원 중부작물부 작물연구동 시험연구포장(경기도 수원시, N126°58′E37°15)에서 수행하였다. 2022년 4월 28일에 재식거리 60 × 25 cm로 광평옥 종자를 주당 2립으로 무피복 파종하여 3~5엽기(V3 stage)에 솎아 1주만 남겼다. 시비는 N-P2O5-K2O-퇴비를 20-15-15-2,000 kg/10a로 시용하였으며, 질소(N)는 기비와 추비로 1:1로 나누어 주고, 인산(P2O5), 칼리(K2O), 퇴비는 전량 기비로 시용하였다. 재배관리는 농촌진흥청 농업과학기술 연구조사분석기준에 따랐다(RDA, 2012). 연구에 사용된 시험재료인 광평옥은 사일리지 및 종실용으로 국내에서 널리 보급되어 이용되고 있는 단교잡 옥수수 품종이다. 이삭 수확은 출사(Silking) 후 3일(R1 stage)부터 54일(R6 stage)까지 3일 간격으로 하였으며 액체 질소에 넣어 종실과 속대를 분리하였다. 분리한 속대와 종실은 동결건조하여 분쇄기로 갈아 100 mesh sieve로 거른 시료를 분석에 사용하였다.
Crude fat 함량 분석
옥수수 속대와 종실의 crude fat 함량은 Soxtherm Automatic System (Gerhardt Soxtherm 2000, Hoffmannstre, Germany)으로 정량하였다(Lee et al., 2015). 분쇄 시료 3 g과 boiling stone을 extraction thimble에 넣고 n-hexane 140 mL을 추가하여 180°C에서 30분간 가열하여 샘플에서 crude fat을 용출하였다. 그 후 80분 동안 5회에 걸쳐 반복 추출한 후 용매를 회수하였다. 용매를 회수한 extraction thimble을 105°C에서 1시간 동안 건조시키고 실온의 desiccator에서 30분간 방냉 후 무게를 측정하여 crude fat 함량을 계산하였다.
Fatty acid composition 분석
Garces의 방법을 변형하여 옥수수 속대와 종실의 fatty acid composition을 평가하였다(Garcés & Mancha, 1993). 시료 0.5 g에 2 mL의 methanol : heptane : benzene : 2,2-dimethoxypropane : H2SO4 (37 : 36 : 20 : 5 : 2, v/v) 혼합 용매를 가하여 80°C에서 1시간 가열하여 반응시키고 방냉 후 FAME (fatty acid methyl ester)를 포함하는 상등액을 취하여 gas chromatography (GC)로 fatty acid를 분석하였다. GC 분석은 AOC-20i auto injector가 장착된 Shimadzu GC-2010 plus (Kyoto, Japan)에 Agilent HP-Innowax capillary column (30 m × 0.25 mm × 0.25 μm, Palo Alto, CA, USA)을 장착하여 수행하였다. Injector와 FID 온도는 250°C와 260°C로 설정하였으며 오븐 온도 프로그램은 초기 온도 150°C에서 최종 온도 240°C까지 3°C/min로 증가시켰다. 표준 물질로 사용한 FAME mix (C8-C22)는 Supelco (Bellefonte, PA, USA)의 제품을 사용하였다.
Amino acid 분석
Amino acid 자동분석기(L-8800 high-speed amino acid analyzer, Hitachi, Tokyo, Japan)를 이용하여 옥수수 속대와 종실의 free amino acid를 분석하였다(Shimbo et al., 2010). Pyrex glass tube에 분쇄 시료 0.5 g을 칭량하여 6N hydrochloric acid (HCl) 10 mL을 넣고 tube 내부를 N2 gas로 치환한 후 밀봉하였다. 밀봉한 tube는 110°C 항온기에서 넣어 24시간 동안 가수분해 하였다. 가수분해 된 시료를 실온에서 냉각한 뒤 100 mL mass flask에 증류수로 mass up한 뒤 Whatman No. 2 filter paper (Whatman, Maidstone, England)로 여과하였다. 여과한 용액은 methanol과 증류수로 활성화한 Sep-Pak® plus C18 cartridge (WAT036575, Waters)에 통과시켜 불순물을 제거하고 분석 시료로 사용하였다.
Amino acid 분석시 PH1, PH2, PH3, PH4, PH-RG, R-3, C-1, ninhydrin solution, buffer solution (Wako Pure Chemical Industries, Osaka, Japan)을 이동상으로 하고, column은 ion exchange column #2622SC PF 4.6 mm × 60 mm (Hitachi, Tokyo, Japan)를 사용하였다. Column 온도는 50°C, reaction chamber 온도는 135°C로 설정하였으며 amino acid calibration mixture (Ajinomoto-takara, Kusatsu, Japan)를 아미노산 표준물질로 사용하였다.
Phytosterol 분석
옥수수 속대와 종실의 phytosterol은 Shimadzu gas chromatography system을 이용하여 분석하였다(Jekel et al., 1998). 분쇄시료 100 mg에 ethanol 4 mL과 0.1 N ethanolic KOH 1 mL을 가하여 95°C에서 1시간 동안 비누화 반응(saponification)을 유도하였다. 비누화 반응이 끝난 시료는 실온에서 냉각하고 saturated NaCl 5 mL과 n-hexane 10 mL을 각 시료에 첨가하여 강하게 vortexing 후 상등액을 회수하였다. 3회 반복 추출 후 회수한 상등액은 질소 농축기로 농축하였다. 1 mL의 n-hexane을 가하여 시료를 회수하고 0.45 μm syringe filter로 여과한 후 phytosterol 함량 분석을 수행하였다. Shimadzu GC-2010 plus (Kyoto, Japan)에 Agilent DB-5MS UI (30 m × 0.25 mm × 0.25 μm, Palto Alto, CA, USA) capillary column을 연결하여 FID (flame ionization detector)를 사용하여 분석하였다. Injector 온도는 270°C, FID 온도는 300°C로 설정하고 오븐 초기 온도 105°C에서 20°C/min로 272°C까지 증가 시켰다. 표준물질로 사용한 campesterol, stigmasterol, β-sitosterol은 Sigma-Aldrich (St. Louis, MO, USA) 제품을 사용하였다.
통계분석
모든 시험은 3반복으로 수행되었으며, 분석결과는 평균(mean)±표준편차(standard deviation)로 나타내었다. JAMOVI v1.2.27 (jamovi.org)로 기초통계량, 분산분석, 상관분석을 수행하였다. 이삭 성숙 기간 동안 속대와 종실의 성분 함량 차이는 일원변량분산분석(One-way ANOVA) 후 사후검정으로 Tukey’s honestly significant difference test를 수행하여 p < 0.05에서 유의수준 차이를 검정하였다. 주성분 분석(principal components analysis)과 군집 분석(hierarchical clusters analysis)은 MetaboAnalyst5.0 (http://www.metaboanalyst.ca)으로 시각화하였다(Pang et al., 2022).
결과 및 고찰
옥수수 이삭이 성숙하는 동안 속대와 종실의 crude fat과 fatty acid의 변화
중요한 plant sterol 공급원으로 옥수수(Zea may L.), 대두(Glycine max (L.) Merr.) 등에서 추출한 식물성 기름이 널리 이용되고 있다(Normén et al., 2007). 또한 fatty acid는 세포의 특성에 영향을 미쳐 신진대사, 유전자 발현, 생리활성 화합물의 생산에 변화를 유도한다(Calder, 2015). 그러므로 먼저 옥수수 이삭 등숙에 따른 종실과 속대의 crude fat 함량과 fatty acid 구성 변화를 확인하였다. 옥수수 종실은 출사 후(DAS, day after silking) 9일부터 이삭에 나타나기 시작했다. 9 DAS 종실은 옥수수 성장 단계 중 R1 stage에서 R2 stage로 넘어가는 시기로, 이 시점의 옥수수 종실은 겉은 흰색이고 안쪽에는 투명한 액체가 들어 있는 상태이다. 종실의 crude fat 함량은 9 DAS에서 1.84±0.04%에서 30 DAS까지 4.82±0.19%로 지속적으로 증가했으며, 생리적으로 완전히 성숙되는 54 DAS (R6 stage)까지 안정적으로 유지되었다(Fig. 1). 옥수수 속대에서는 crude fat 함량이 3 DAS에 2.51±0.06%에서 9 DAS에 0.68±0.06%로 지속적으로 감소하며 배유가 형성되는 시기와 일치했으며, 이 수준은 54 DAS까지 유지되었다. 옥수수 이삭 성숙 단계에서 종실이 성숙함에 따라 crude fat 함량이 꾸준히 증가했으며, 15 DAS와 21 DAS에서 급격한 함량 증가가 관찰되었다. 이러한 결과는 옥수수 배유에 crude fat이 축적되는 것이 주로 종실 성숙 중기단계에서 발생한다는 것을 시사한다.

Fig. 1.
Changes in crude fat content in corn cobs and kernels throughout the maturation of corn ears. The experiments were conducted in triplicate, and the results were presented as the mean±standard deviation. Variations in crude fat content among the samples were assessed using one-way ANOVA with a significance level of p < 0.05. Different letters represent significant distinctions among the samples as determined by Tukey’s honestly significant difference post hoc test.
옥수수 속대에서 측정한 5가지 fatty acid (palmitic acid (C16:0), stearic acid (C18:0), oleic acid (C18:1), linoleic acid (C18:2), linolenic aicd (C18:3))는 종실이 성숙하는 동안 역동적인 변화를 나타내었다(Fig. 2A). Linoleic acid는 3 DAS 속대에서 53.90±2.47%로 5가지 fatty acid 중 가장 비율이 높았지만, 이삭이 성숙함에 따라 지속적으로 감소한 반면 stearic acid과 palmitic acid의 비율은 점차 증가했다. 반면 옥수수 종실의 fatty acid는 9–15 DAS까지 변동이 있었지만, 18 DAS부터 종실의 완전한 성숙이 이루어지는 54 DAS까지 일정한 비율을 나타냈다. 9 DAS 종실에서는 linoleic acid (45.28±2.70%)와 palmitic acid (37.93±1.84%)가 전체 지방산의 83.21%를 차지했으나 12 DAS부터 oleic acid의 비율이 증가했고, 이후 saturated fatty acid (palmitic acid, stearic acid)의 비율이 점차 증가해 21 DAS부터 일정한 조성을 보였다(Fig. 2B).
Palmitic acid은 신장을 거쳐 stearic acid를 형성하고, 이후 stearoyl-CoA desaturase에 의해 C18:1 unsaturated fatty acid (oleic acid)로 전환된다(Dey & Harborne, 1997). 이삭 성숙 초기의 속대와 종실에서 관찰된 fatty acid 조성의 변화는 palmitic acid가 stearic acid로 전환된 것에 기인할 수 있다. 그러나 옥수수 종실이 생리적 성숙 후기 단계에 도달하면 stearic acid가 oleic acid로 전환되는 양은 최소화된다.
옥수수 이삭이 성숙하는 동안 속대와 종실의 phytosterol 함량 변화
옥수수 속대와 종실 모두 이삭이 성숙함에 따라 total phytosterol 함량이 점진적으로 감소하였다(Fig. 3). 옥수수 속대의 경우 3 DAS에서 113.38±4.51 mg/100g DW, 종실의 경우 9 DAS에서 62.72±2.79 mg/100g DW로 각 조직의 발달 초기 단계에서 가장 높은 수준의 total phytosterol이 관찰되었다(Fig. 3A, 3B). 또한 옥수수 속대와 종실 모두 조사된 세 가지 주요 phytosterol인 campesterol, stigmasterol, β-sitosterol 중 β-sitosterol의 비율이 가장 높았다. 이삭이 성숙하는 동안 phytosterol 함량이 점진적으로 감소하는 것은 phytosterol이 세포막 관련 대사 과정을 조절하는 필수 구조 성분으로 작용하기 때문일 가능성이 높다. Plant sterol은 식물 세포의 구조적 조직이 가장 활발한 발달 초기 단계에서 상당량 발현된 후 구조적 성숙이 진행됨에 따라 비교적 안정적인 수준을 유지하는 것으로 보인다. 이러한 결과는 어린 옥수수 이삭을 식용으로 이용하는 baby corn이 phytosterol 공급원으로 우수한 재료임을 시사한다.
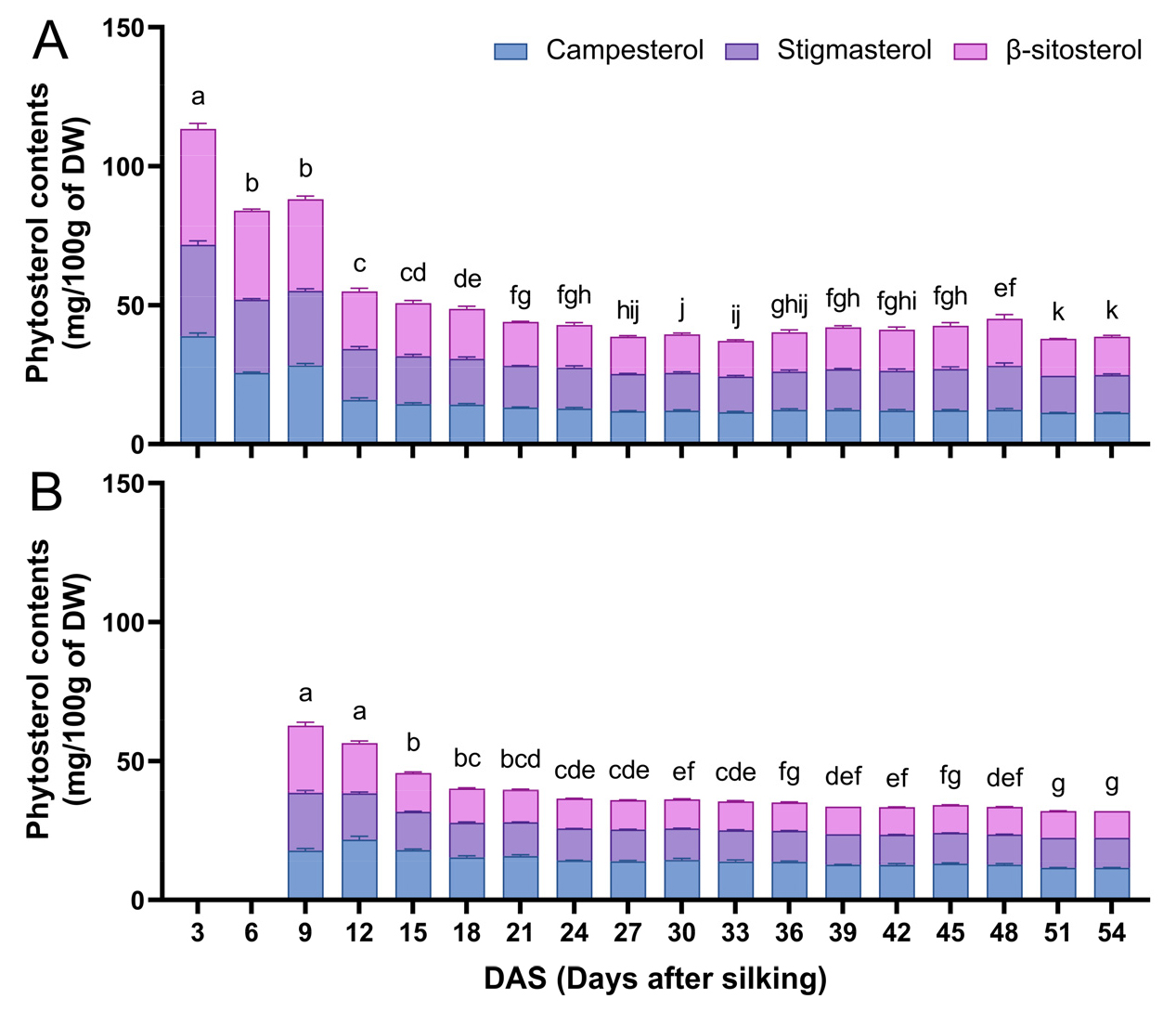
Fig. 3.
Quantification of phytosterol content in corn cobs (A) and kernels (B) during the filling of corn ears. The data is displayed as the mean±standard deviation, where the total phytosterol content is represented by the sum of campesterol, stigmasterol, and β-sitosterol content. Different letters indicate significant differences at p < 0.05 from a one-way ANOVA for total phytosterol contents.
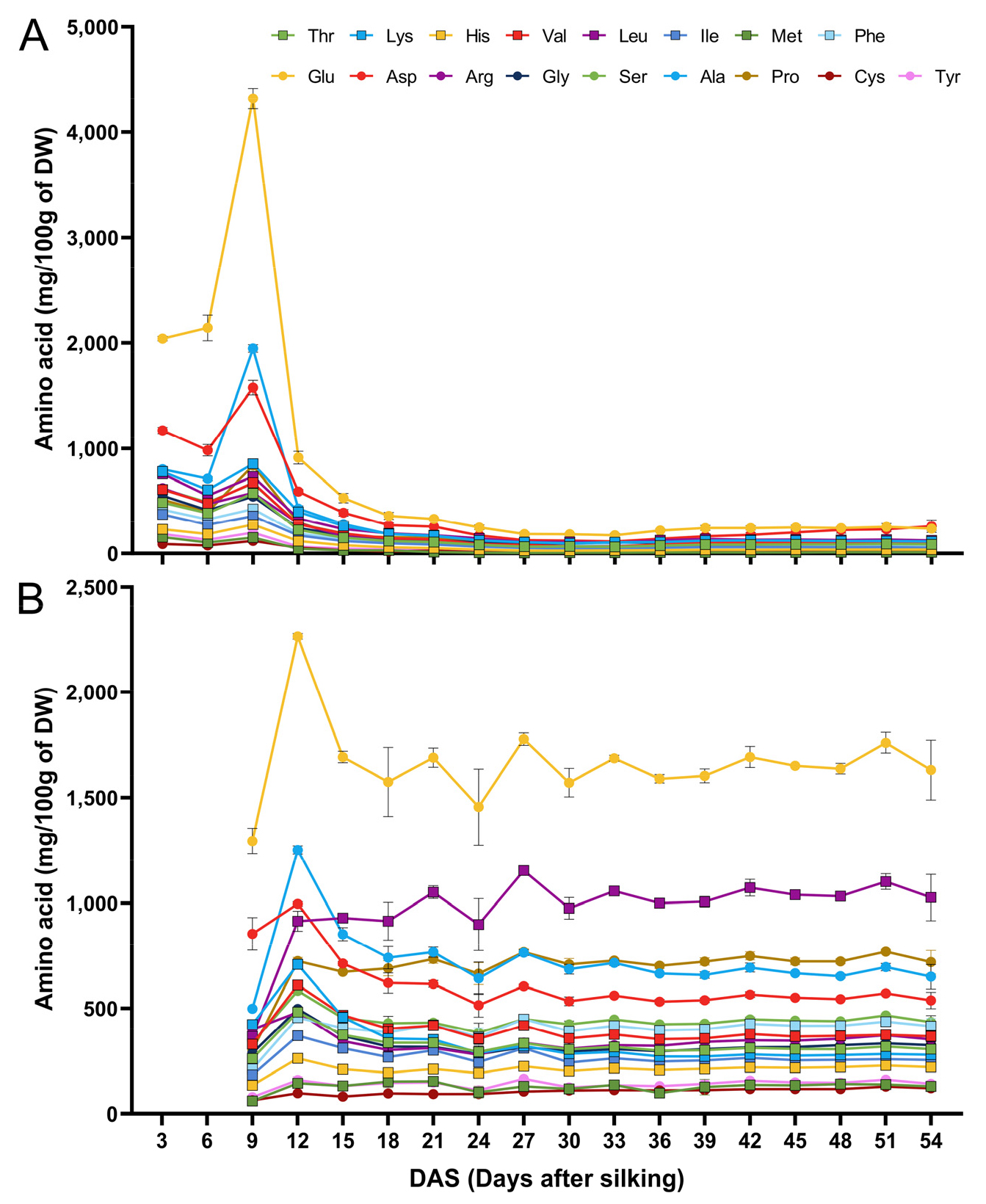
옥수수 이삭 등숙 기간 동안의 속대와 종실의 amino acid 함량 변화
Amino acid와 phytosterol 두 화합물은 cholesterol 합성에 관여한다(Masisi et al., 2017). Cholesterol은 acetyl-CoA로부터 생성되며, amino acid 역시 acetyl-CoA로 전환될 수 있으므로 cholesterol 생성에 기여할 수 있다(Bradshaw & Stahl, 2015; Ha & Bhagavan, 2011). 또한 L-arginine과 같은 특정 amino acid가 cholesterol 저하 효과가 있다는 연구도 보고되고 있다(Hadi et al., 2019). 그러므로 옥수수 이삭의 생리적 성숙 단계에 따른 이삭의 amino acid 함량 변화를 phytosterol 함량 변화와 비교해 보고자 하였다. 옥수수 속대와 종실의 amino acid 함량은 지속적으로 축적되기 보다 상당한 변동성을 보였다(Fig. 4). 옥수수 속대에서는 대부분의 amino acid가 9 DAS에서 최고 수준에 도달한 후 감소하였다(Fig. 4A). 반면, 종실에서는 amino acid가 12 DAS에 정점에 도달한 후 감소하는 경향을 보였다(Fig. 4B). Glutamic acid는 속대와 종실 모두에서 가장 함량이 높은 amino acid로 확인되었다. 대부분의 amino acid은 옥수수 속대와 종실 모두에서 유사한 축적 패턴을 보였지만, leucine과 glutamic acid는 종실 실험군 간에 큰 표준 편차를 보였다. Amino acid가 식물 조직에서 필수 구성 요소 역할을 한다는 점을 고려할 때, 옥수수 속대와 종실이 성숙함에 따라 amino acid 함량이 감소하는 것은 옥수수 이삭에 다양한 phytochemical이 축적되는 것과 관련이 있을 수 있다. 옥수수 속대에 대한 일반적인 인식은 일시적인 저장 기관이자 발달 중인 종실에 영양분을 전달하는 통로 역할을 한다는 것이지만, 속대가 종실의 성장에 중요한 대사적 역할을 한다는 것은 분명한 사실이다(Crawford Jr et al., 1982; Felker, 1992). 옥수수 속대의 amino acid 함량이 급격히 감소하는 기간 동안 종실의 amino acid 함량은 정점에 도달했다. 이는 옥수수 종실의 싱크가 발달하지 않았을 때 속대에 아미노산이 일시적으로 축적되었다가 종실의 생리적 성숙을 위해 amino acid가 속대에서 종실로 이동했을 가능성을 시사한다.
옥수수 속대와 종실의 생리적 성숙 단계의 phytosterol, crude fat, fatty acid, amino acid 구성에 따른 분류
분석된 옥수수 속대 성분 간의 pearson correlation matrix에서 palmitic acid와 stearic acid는 crude fat, campesterol, stigmaterol, β-sitosterol 및 17개 amino acid 성분 모두와 강한 음의 상관관계를 보였으며, 옥수수 속대의 주요 성분인 campesterol, stigmasterol, β-sitosterol은 17개 amino acid 성분 모두와 유의 수준 P <0.001에서 r = 0.763 이상의 강한 양의 상관관계를 보였다(Fig. 5A). 종실의 경우 crude fat은 campesterol (r = -0.828, P <0.01), stigmasterol (r = -0.884, P <0.01), β-sitosterol (r = -0.884, P <0.01)과 강한 음의 상관관계를 나타냈다(Fig. 5B). 또한 campesterol, stigmaterol, β-sitosterol은 lysine (r = 0.915, 0.693, 0.693, P < 0.01), aspartic acid (r = 0.873, 0.845, 0.845, P < 0.01)과 강한 양의 상관관계를 보였고 cysteine (r = -0.706, -0.789, -0.789, P < 0.01)과는 강한 음의 상관관계를 보였다.
다양한 화합물 간의 특성을 비교하고 분류하는 데 유용한 분석법인 hierarchical clustering heatmap analysis에서 샘플들은 두 개의 뚜렷한 그룹으로 분리되었다(Barth et al., 2020). Group I은 종실 샘플로 구성되었고, Group II는 옥수수 속대 샘플로 구성되었다(Fig. 6). Group I은 crude fat과 주요 amino acid 함량이 높은 반면, group II는 phytosterol 함량이 높고 saturated fatty acid 비율이 높은 것이 특징이었다. 대부분의 종실 샘플이 group I에 속했지만, 한 가지 예외가 있었는데, 미성숙 종실인 9 DAS 종실은 group II의 옥수수 속대 샘플과 함께 그룹으로 분류되었다.

Fig. 6.
Clustering heatmap analysis of compound content changes during corn ear maturation. Each sample name is indicated by both letters and a number, where letters represent the tissue type (cob or kernel) and the number represents the days after silking (DAS). Each parameter level is mapped to the color scale, with the color transition from blue to red indicating low to high levels of the normalized response.
Phytosterol, crude fat, fatty acid, amino acid 함량을 고려하여 PCA를 수행하였다. PC1과 PC2는 전체 샘플 분산의 94.5%를 차지했으며, PC1이 72.9%, PC2가 21.6%였다(Fig. 7A). Loading plot에서 campesterol, stigmaterol, β-sitosterol 세 가지 phytosterol은 PC1과 PC2 모두에서 음의 부하를 보인 반면, crude fat 함량은 PC2에서 양의 부하를 나타냈다(Fig. 7B). Score plot에서 옥수수 속대와 종실은 서로 다른 영역을 차지했으며, crude fat 함량이 높은 종실은 plot의 왼쪽 상단에 위치했다. 속대 샘플은 PC1의 음의 방향으로 모여 있는 반면, 종실은 PC2를 따라 한 group (종실 12–54 DAS)은 양의 방향으로, 다른 group (종실 3–9 DAS)은 음의 방향으로 두 그룹으로 나뉘어 생리적 성숙도의 차이를 반영하고 있었다. Loading plot에서 β-sitosterol과 stigmasterol은 밀접하게 정렬되었다(Fig. 7B). 이러한 결과는 옥수수 속대와 종실에서 phytosterol을 포함한 다양한 화합물의 수준이 옥수수 이삭의 생리적 성숙 단계에 영향을 받는다는 것을 시사한다.
본 연구를 통해 옥수수 이삭의 생리적 성숙 기간 동안의 phytosterol 함량 변이를 평가하였다. 옥수수 속대를 새로운 phytosterol 공급원으로써 활용하기 위한 적합 시기는 생리적 성숙 단계 초기인 R1–R2 stage로 이 시기에 phytosterol 함량이 가장 높게 나타났다. 이러한 결과는 baby corn을 활용 할 수 있는 작부 체계 개발 등의 활용 방안에 대한 추가적인 탐색이 필요하며, baby corn이 식의약품 소재로 활용될 수 있는 우수한 잠재력을 가지고 있음을 시사한다. 또한 찰옥수수 및 초당옥수수 등 유전적 배경이 다른 옥수수 속대의 phytosterol 함량 변이에 대한 추가 연구는 옥수수 농업 부산물의 활용도를 확대시킬 수 있을 것이다.
적 요
본 연구에서는 농업부산물인 옥수수 속대의 생리활성 화합물 공급원으로의 잠재적 활용 가능성을 탐색하기 위해 이삭의 성숙 단계에 따른 phytosterol 함량 변화를 측정하였다.
1. 옥수수 이삭의 crude fat 함량 변이는 속대가 3 DAS에서 54 DAS까지 2.51±0.06–0.33±0.04%, 종실은 9 DAS에서 54 DAS까지 1.84±0.04–4.91±0.28%로 나타났으며 종실은 성숙할수록 crude fat 함량이 증가하였고 속대는 반대의 경향을 나타내었다.
2. 옥수수 이삭의 등숙 기간 동안 속대와 종실에서 campesterol, stigmasterol, β-sitosterol은 주요 phytosterol로 검출되었으며, total phytosterol 함량은 속대가 3 DAS에서 54 DAS까지 134.84±4.58–48.86±0.89 mg/100g DW, 종실은 9 DAS에서 54 DAS까지 83.15±2.74–42.12±0.08 mg/100g DW로 생리적 성숙 초기 단계에 가장 높은 함량을 보인 뒤 점차적으로 감소하였다.
3. Hierarchical clustering heatmap analysis와 principal component analysis에서 옥수수 속대와 종실은 생리적 성숙 단계 및 조직 부위에 따라 구분이 되었다. 옥수수 속대를 새로운 phytosterol 공급원으로써 활용하기 위해 함량이 가장 풍부한 시기는 R1–R2 stage이며, 이삭 성숙 전체 단계에서 속대에는 종실보다 많은 phytosterol이 존재하므로 농업부산물인 속대를 새로운 phytosterol 공급원으로 활용할 수 있을 것이다.