서 론
재료 및 방법
시험재료
수분부족처리
생육조사
잎의 상대적 수분 함량(Relative water content, RWC)
잎의 엽록소 함량, 기공전도도 및 광합성률의 측정
단백질 추출
2-D gel 이미지 분석
MALDI-TOF MS 분석
Semi-quantitative RT‑PCR
통계처리
결과 및 고찰
적 요
서 론
수분은 작물의 생장 및 생산성을 제한하는 중요한 환경요인이다(Araus et al., 2002). 최근 기후변화로 인해 전 세계적으로 물 부족 현상이 늘어나면서 가뭄은 심각한 문제로 대두되고 있다(Dai, 2012). 옥수수(Zea mays L.)는 주요한 식량 작물 중 하나로 음식, 다양한 산업 및 바이오에너지 생산 용도로 이용된다고 알려져 있다(Cordell et al., 2011). 이러한 옥수수는 불량 환경에 잘 적응하지만 물 부족과 같은 수분 스트레스에 매우 취약하다고 보고되었다(Lobell et al., 2011).
수분 부족은 옥수수 생육 초기 발달과 성장을 억제 할 뿐만 아니라 생식 단계에서의 알곡크기, 이삭크기 등 옥수수 성장에 상당한 영향을 미치며(Bassetti & Westgate, 1993; Farré & Faci, 2006), 광합성 활동이 감소한다고 알려져 있다(Yordanov et al., 2003; Zlatev & Yordanov, 2004). 또한, 식물은 수분 손실을 줄이기 위하여 가장 빠른 반응으로 기공 폐쇄를 일으키며, 이는 CO2 흡수를 감소시켜 광합성 활동을 감소시킨다고 하였다(Nayyar & Gupta, 2006).
최근에 기후변화로 인하여 우리나라는 봄 가뭄이 길어지면서 옥수수 생육 초기에 한발 피해가 자주 발생하며, 일반적으로 옥수수에서 본 잎이 6개가 발생하는 유수가 형성되는 시기 때쯤 수분 스트레스에 매우 약한 것으로 알려져 있다(Abendroth et al., 2011). 수분 부족 스트레스는 식물체 내에 복잡한 분자생리학적 반응을 야기시키기 때문에, 프로테옴 분석을 이용하여 수분 부족에 대한 옥수수의 분자생화학적 반응을 조사하였다(de Vienne et al., 1999; Benešová et al., 2012; Riccardi et al., 2004). 비록 수분 부족 스트레스에 직접적으로 영향을 미치는 분자생물학적 구명 연구가 많이 수행되었지만, 농촌진흥청에서 개발한 옥수수 품종을 대상으로 수분 부족 스트레스에 대한 분자생물학적 변화, 그 중에서 단백질 발현 연구는 거의 진행되지 않았다. 따라서 본 연구에서는 옥수수 유수형성기에 수분부족처리를 하여 농촌진흥청에서 개발된 옥수수 F1 교잡종 일미찰(Ilmi)과 광평옥(GPOK)의 광합성 반응과 단백질체의 변화를 조사하였다.
재료 및 방법
시험재료
본 연구는 국립식량과학원 시험연구포장(경기도 수원시)에 있는 비가림 비닐하우스에서 수행하였다. 실험 식물은 국립식량과학원에서 개발하여 널리 재배되고 있는 F1 교잡종인 일미찰(찰옥수수)과 광평옥(일반옥수수) 으로 플라스틱 14.7 L 원형 포트(25 cm 직경 × 30 cm 높이)에 사양토를 채워 놓고 각 품종 종자 3개씩 4월 29일 파종하였다. 옥수수가 출아하고 본엽이 2매가 되었을 때 생육이 균일한 개체를 포트당 1개체씩 남기고 제거하였다. 비료는 농촌진흥청 표준시비량(N-P2O5-K20 = 72.5-30-60 kg/ha)에 따라 처리하였다.
수분부족처리
옥수수 식물체의 본 잎이 6개가 되었을 때(유수형성기) 수분 부족 스트레스를 처리하기 위하여 물 공급을 중단하였고, 4~5일이 경과하면서 토양 수분이 약 10% (v/v)이하로 떨어졌으며 이 시기에 잎의 위조 현상이 시작되었다. 잎의 위조 현상 시작 이후 10일 동안 물을 공급하지 않았다. 정상 수분처리 포트는 토양 수분이 20% (v/v) 이하로 떨어지지 않도록 하루 한시간 동안 수분을 매일 공급(2.4 L)하였다. 포트의 토양수분 관리는 포트마다 점적관수 시스템(Netafim Ltd., Israel)을 설치하여 관리하였으며 용적 토양 수분은 커패시턴스형 센서(SM100, Spectrum Technologies, Inc., USA)을 사용하여 측정하였다. 시험구 배치는 완전임의배치법에 따랐으며 3반복으로 처리하였다.
생육조사
10일간 수분부족처리가 끝나고 수분부족처리구와 정상수분처리구 식물체의 살아 있는 잎의 수와 잎면적측정기(LI- 3100C, Li-Cor Inc., USA)를 이용하여 식물체의 잎 면적을 조사하였다. 또한, 식물체의 줄기의 길이와 직경, 웅수(tassel)의 길이를 조사하고, 잎, 줄기, 웅수, 뿌리의 건물중을 조사하였다.
잎의 상대적 수분 함량(Relative water content, RWC)
잎의 수분 상태를 알아 보기 위하여 잎의 상대적 수분함량을 측정하였다(Smart&Bingham, 1974). 물 공급을 중단한 후 잎에 위조 현상이 나타난 지 10일째에 옥수수의 최상위 완전전개잎 중간 부분 5 cm정도를 채취하여 잎의 생체중(fresh weight)을 측정하고, 그 잎을 물에 침지하여 냉장고(4°C)에 48시간 동안 치상한 다음 겉에 묻은 물기를 종이타올로 제거하고 무게(turgid weight)를 측정하였다. 이 잎을 드라이 오븐(70°C, 5일)에서 건조한 다음 잎의 건물중(dry weight)을 측정하였다. 잎의 상대적 수분함량(RWC)은 다음과 같이 구하였다.
잎의 엽록소 함량, 기공전도도 및 광합성률의 측정
수분공급을 중단하여 잎의 위조증상이 나타나고 10일 째 되었을 때, 옥수수 최상위 완전전개잎의 엽록소 함량은 휴대용 엽록소 측정기(Konica Minolta SPAD 502 Plus Chlorophyll Meter, Spectrum Technologies, Inc., IL, USA)를 사용하여 측정하였다. 그리고 잎의 기공전도도와 광합성률은 휴대용 광합성측정장치(Li-6400, LI COR, Lincoln, NB, USA)을 사용하여 측정하였다. 광합성측정장치 챔버의 모든 조건은 측정하는 동안 표준화하였다(잎 온도 25°C, 광합성유효광량자속밀도(PPFD) 1500 µmol quanta·m-2·s-1) (Kim et al., 2015).
단백질 추출
단백질은 이전에 보고된 방법으로 옥수수 잎으로부터 추출하였다(Kim et al., 2008). 간단히 요약하면, 옥수수 F1 교잡종 일미찰과 광평옥(3개의 독립된 재료들)을 액체 질소와 막자를 이용하여 미세한 가루로 분쇄하였고, 0.5 M Tris-HCl (pH 8.3)과 2% β-mercaptoethanol이 포함된 5 mL의 Mg/NP-40 버퍼를 사용하여 균질화하였다. 그리고 나서 샘플들은 4°C에서 10분 동안 12,000×g에서 원심분리 하였다. 상등액과 동일한 양으로 Tris로 포화된 페놀(pH 7.5)을 첨가하여 섞어주고, 4°C에서 10분 동안 12,000×g에서 원심분리하였다. 페놀 층은 0.1 M ammonium acetate을 포함한 메탄올을 4배 양을 첨가하여 섞은 후, 1시간동안 -20°C에서 침전하였다. 그리고 나서 샘플은 4°C에서 10분 동안 12,000 ×g에서 원심분리 하였다. 침전물은 이전에 보고된 방법을 따라 아주 찬 acetone 5 mL을 가지고 3번 씻어 내었고(Kim et al., 2008), 단백질 정량을 위하여 필요할 때까지 –20°C에서 80% acetone 안에 보관하였다.
2-D gel 이미지 분석
2-D gel 이미지는 Kim et al. (2008)에서 보고된 방법으로 분석하였다. 단백질 침전물은 rehydration buffer로(GE Healthcare, Waukesha, WI, USA)으로 녹였다. Immobilized pH gradient (IPG) strips (24 cm)를 rehydration 시킨 후, rehydration buffer와 단백질 (250 μg)을 1:1로 섞어 로딩하였다. 그리고 나서 IPGphor II platform (GE Healthcare, Waukesha, WI, USA)을 사용하여 50 V에서 4 h, 100 V에서 1 h, 500 V에서 1 h, 1000 V에서 1 h, 2000 V에서 1 h, 4000 V에서 2 h, 8000 V에서 14 h, 그리고 60 V에서 6 h 1-DE를 수행하였다. 2-DE 분석은 13% SDS-polyacrylamide gel를 사용하였으며, colloidal Coomassie Brilliant Blue (CBB)로 염색하였다. 데이터 정확성을 위해서 생물학적 3반복을 통하여 2-DE분석을 실시하였다. Gel 이미지는 UMAX 스캐너(PowerLook 1120)을 이용하여 분석되었으며, 단백질 spot은 ImageMaster 2D Platinum software 6.0 (GE Healthcare, Waukesha, WI, USA)을 사용하여 정량분석을 하였다.
수분을 정상 공급한 옥수수 교잡종과 수분부족처리를 한 옥수수 교잡종에서 추출한 단백질은 트립신으로 잘랐을 때, gel상에 다른 단백질 점들을 서로 축적시키는 것을 보여주었다(Kim et al., 2008). CBB로 염색된 단백질 점들은 면도날을 이용하여 2-D gel로부터 잘라내었고, 50% (v/v) acetonitrile (ACN)이 포함된 0.1 M ammonium bicarbonate (NH4 HCO3)으로 씻어낸 후, 진공 건조하였다. 그리고 나서 Gel 조각들은 10 mM DTT을 포함하고 있는 0.1 M NH4HCO3 용액에 담근 후, 55°C에 45분 동안 처리하였다. DTT 용액은 즉시 55 mM iodoacetamide 포함하고 있는 0.1 M NH4 HCO3 용액으로 대체하였고, 샘플들은 30분 동안 어두운 상온에서 보관하였다. Gel 조각들은 50% ACN을 포함하고 있는 0.1 M NH4HCO3 용액으로 씻은 후, 이 조각 안에 들어있는 단백질들은 12.4 ng/μL 트립신(Promega, Madison, WI, USA) 농도에 맞게 25 mM NH4HCO3을 포함하고 있는 가수분해 용액 10 μL에 녹여서 37°C에서 분해하였다. 분해 된 펩타이드 샘플들은 순차적으로 공기 중에서 건조하였다.
MALDI-TOF MS 분석
MALDI-TOF MS분석을 위한 matrix 용액은 acetone에 α- Cyano-4-hydroxycinnamic acid (α-CCA; Sigma-Aldrich)와 nitrocellulose를 최종농도가 각각 40 mg/mL, 20 mg/mL 되게 녹였다(Kim et al., 2014). Isopropano, nitrocellulose 및 α-CCA 용액을 50:50:100 비율로 섞고, 이 용액 2 μL에 peptide 샘플 용액을 동일 양으로 첨가하였다. 이 중 1 μL peptide 용액은 MALDI plate에 즉시 떨어뜨려, 5분 동안 상온에서 둔 후 1% (v/v) TFA 용액으로 씻어 내었다. Peptide spots은 Voyager-DE STR MALDI–TOF mass spectrometer (PerSeptive Biosystems, Framingham, MA, USA)으로 분석하였다. 2개의 내부 표준인 Des-Arg1-bradykinin (m/z = 904.4681)와 angiotensin 1 (m/z = 1296.6853)을 사용하였으며, 500~3000 Da의 분자량을 가진 peptide들은 PerSeptive- Grams software package을 사용하여 분석하였다. 단백질은 Mascot (http://www.matri xscie nce.com)과 Protein Prospector (http://prosp ector.ucsf.edu)을 데이터베이스 통하여 동정하였다.
모든 데이터는 평균 ± 평균오차(SEM)으로 표현하였고, SAS statistical software package ver. 9.2 (SAS Institute, USA)를 사용하여 오차 값을 구하였다.
Semi-quantitative RT‑PCR
PCR은 이전에 보고된 방법으로 수행하였다(Kim et al., 2014). 프라이머들은 200~300 bp 크기로 증폭되게 제작되었다. 옥수수 튜불린 유전자는 각각 샘플들의 cDNA 농도를 정상화하기 위하여 이용되었다. PCR은 유전자 특이적인 프라이머들을 사용하여 실행되었고, DNA 밴드는 1% agarose gel에서 전기영동에 의하여 분리되었다(Additional file 1: Table S1). RT-PCR 과정은 최소 2번 이상 반복되었다.
통계처리
모든 데이터는 평균 ± 평균오차(SEM)으로 표현하였고, SAS statistical software package ver. 9.2 (SAS Institute, USA)를 사용하여 오차 값을 구하였다.
결과 및 고찰
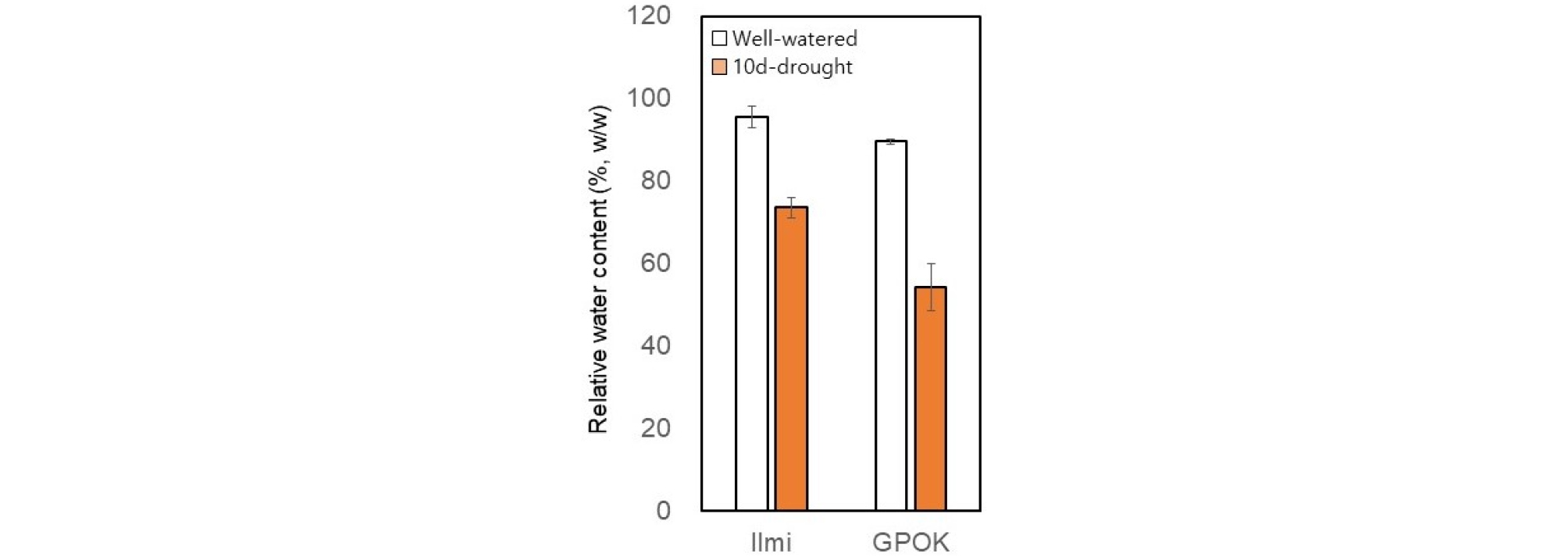
옥수수 유수형성기(본 잎 6개)에 10일 동안 수분부족처리에 의해 일미찰과 광평옥 식물체 잎의 상대적 수분함량은 정상수분처리구보다 각각 23%와 39% 정도 낮았다. 이는 유수형성기 10일간 토양 수분부족이 잎의 수분 부족을 일으켰다는 것을 나타낸다(Fig. 1).
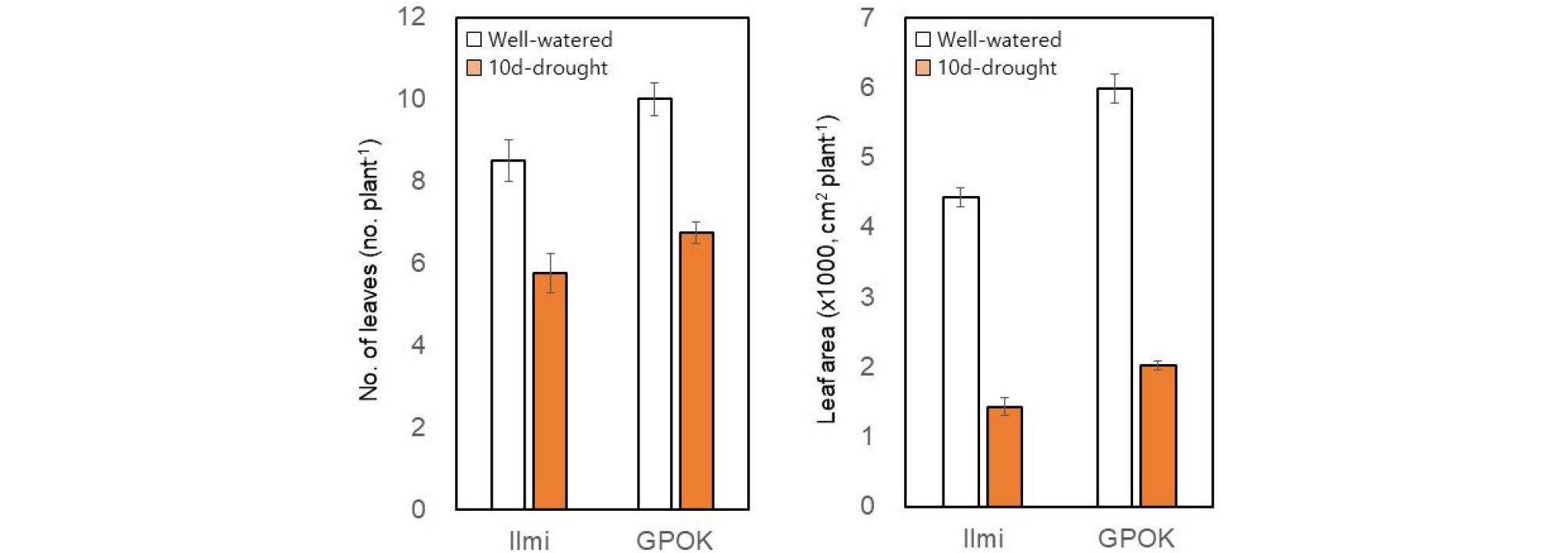
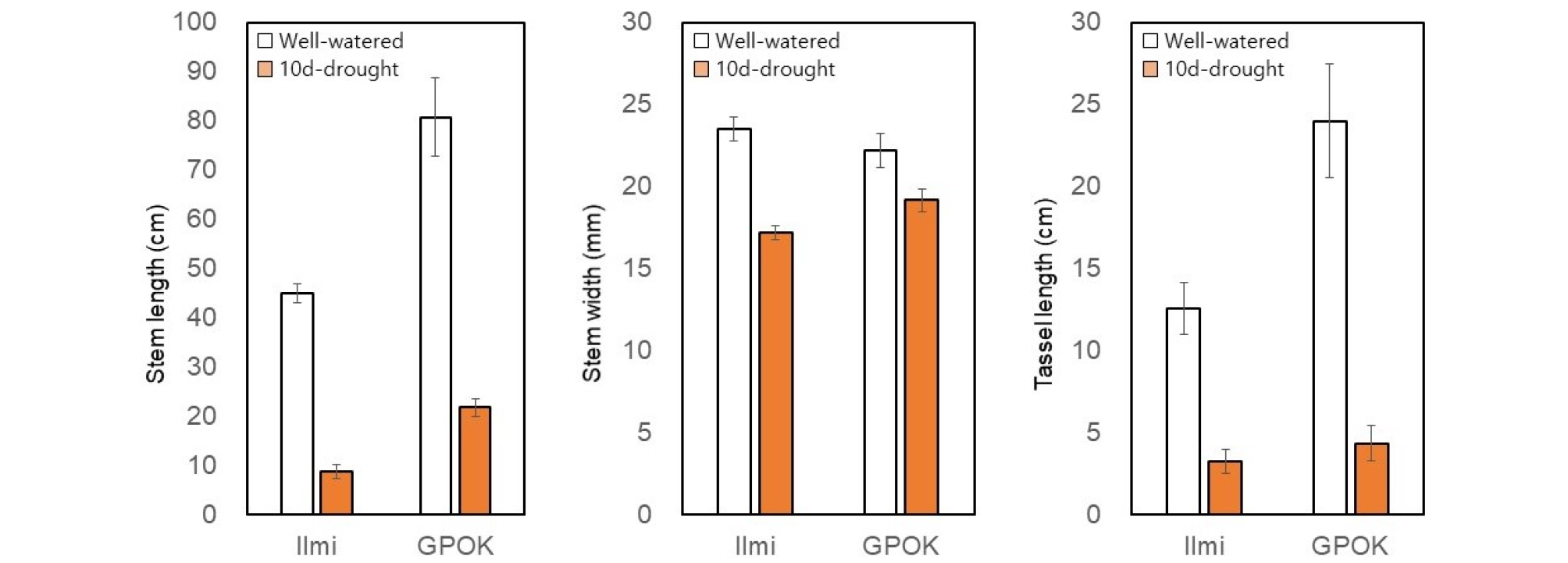
정상수분처리구에 비해 한발처리한 일미찰은 잎 개수가 평균 2.8개, 광평옥은 3.3개 감소하였고, 잎 면적은 일미찰에서 68%, 광평옥에서 66% 정도 감소하였다(Fig 2). 줄기의 길이는 일미찰에서는 약 80%, 광평옥에서는 약 73% 감소하였고, 줄기 직경은 일미찰에서 약 14%, 광평옥에서는 약 27% 줄었다(Fig 3). 이러한 결과는 유수형성기 10일간의 수분 부족 스트레스가 잎 발달과 줄기 신장에 상당한 영향을 미친다는 것을 의미한다.
유수형성기 10일간 수분부족처리구에서는 정상수분처리구와 비교하여 일미찰과 광평옥 식물체의 웅수(tassel) 길이가 각각 74%와 82% 정도 감소하였다(Fig. 3). 본 연구에서 수분부족처리를 한 시기는 유수가 형성되는 시기이다. 따라서 옥수수의 웅수가 형성되기 시작할 때 수분 부족 스트레스를 받았기 때문에 웅수의 길이가 감소한 것으로 보인다(Abendroth et al., 2011; Hsiao, 1973).
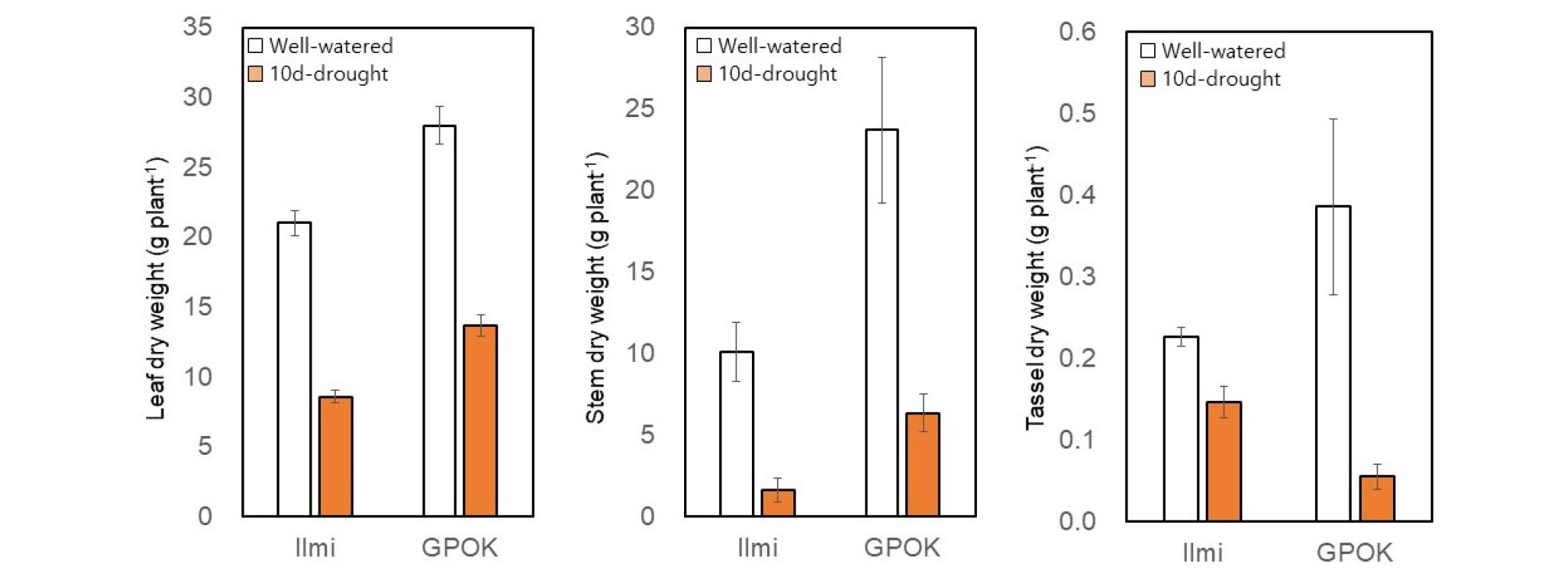
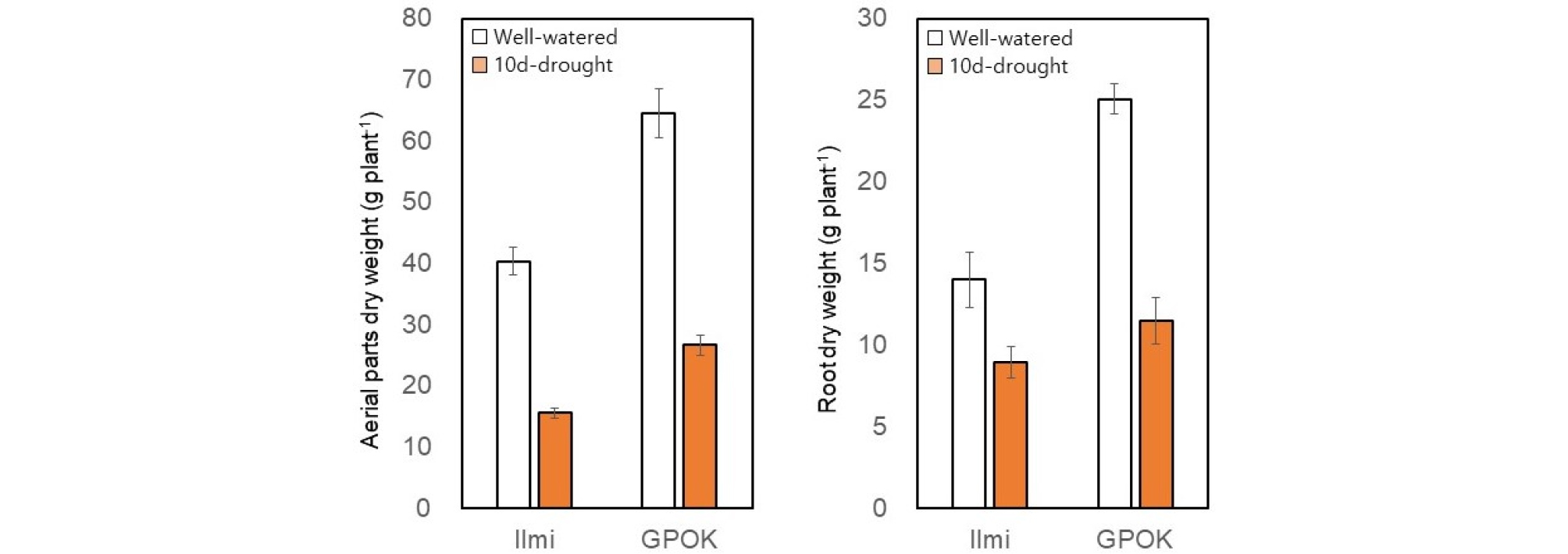
유수형성기(본 잎 6개) 10 일간의 수분부족처리는 옥수수 식물체의 모든 부위에서 건물중을 감소시켰다(Fig. 4). 특히, 줄기의 건물중이 잎과 뿌리보다 훨씬 감소하였다(Fig. 4, Fig. 5). 일미찰과 광평옥에서 잎과 줄기의 건물중은 각각 83%와 73% 정도 감소했으며(Fig. 4), 웅수 건물중은 각각 약 35%와 86% 감소했다(Fig. 4). 결과적으로, 두 옥수수 교잡종의 지상부 총 건물중은 약 60% 감소했으며, 뿌리의 건물중은 일미찰과 광평옥에서 각각 약 36%와 54% 감소했다(Fig. 5). 이러한 결과는 식물 영양생장 단계에서 수분 부족은 초장과 잎의 크기를 감소시켜 줄기와 잎의 건물중을 감소시킨다는 이전의 보고와 일치하였다(Abrecht&Carberry, 1993; Claassen&Shaw, 1970; Denmead&Shaw, 1960; Eck, 1986; Heiniger, 2001; NeSmith&Ritchie, 1992). 그러므로 모든 조직(줄기, 잎 및 웅수)이 빠르게 성장하기 시작하는 단계인 유수형성기에는 수분 부족 스트레스에 민감한 반응하는 것을 알 수 있다(Abendroth et al., 2011; Hsiao, 1973).
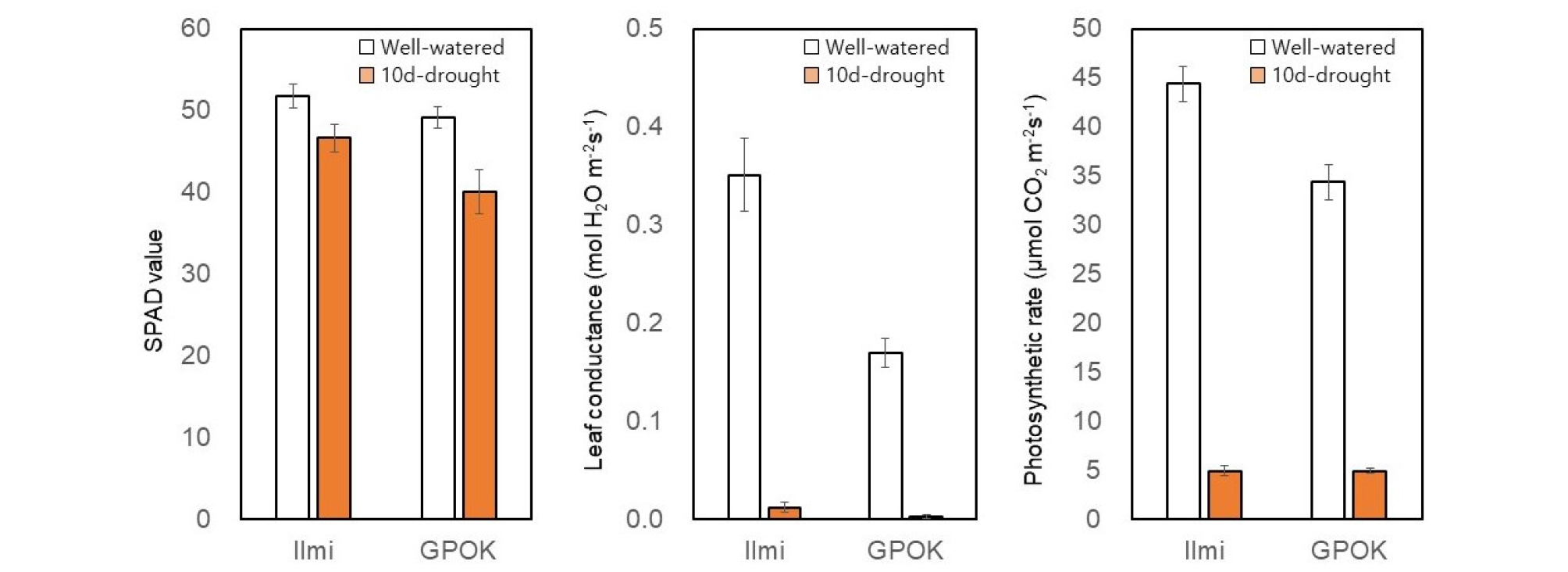
옥수수 유수형성기 10일간 수분부족처리에 의해 잎의 SPAD 값이 일미찰에서 약 10%, 광평옥에서 19% 감소하였다(Fig. 6). 잎의 기공전도도는 유수형성기 10일간 수분부족처리에 의해 일미찰에서 약 96%, 광평옥에서 약 98% 감소되었고, 이와 비슷한 양상으로 광합성도 일미찰에서 89%, 광평옥에서 86% 감소하였다(Fig. 6). 이로 보아 유수형성기에 10일간 한발피해를 입을 경우 광합성이 거의 이루어지지 않는다는 것을 알 수 있었다. Hayano-Kanashiro et al. (2009)은 정상 식물과 비교하여 10 일간의 수분 부족이 기공 전도도를 약 77%까지, 광합성율은 약 78%까지 감소시키는 유사한 결과를 보여 주었다. 이러한 결과는 수분 부족 스트레스에 의한 잎 기공 폐쇄가 광합성을 감소시킨다는 것을 말해주고 있다(Hayano-Kanashiro et al., 2009).
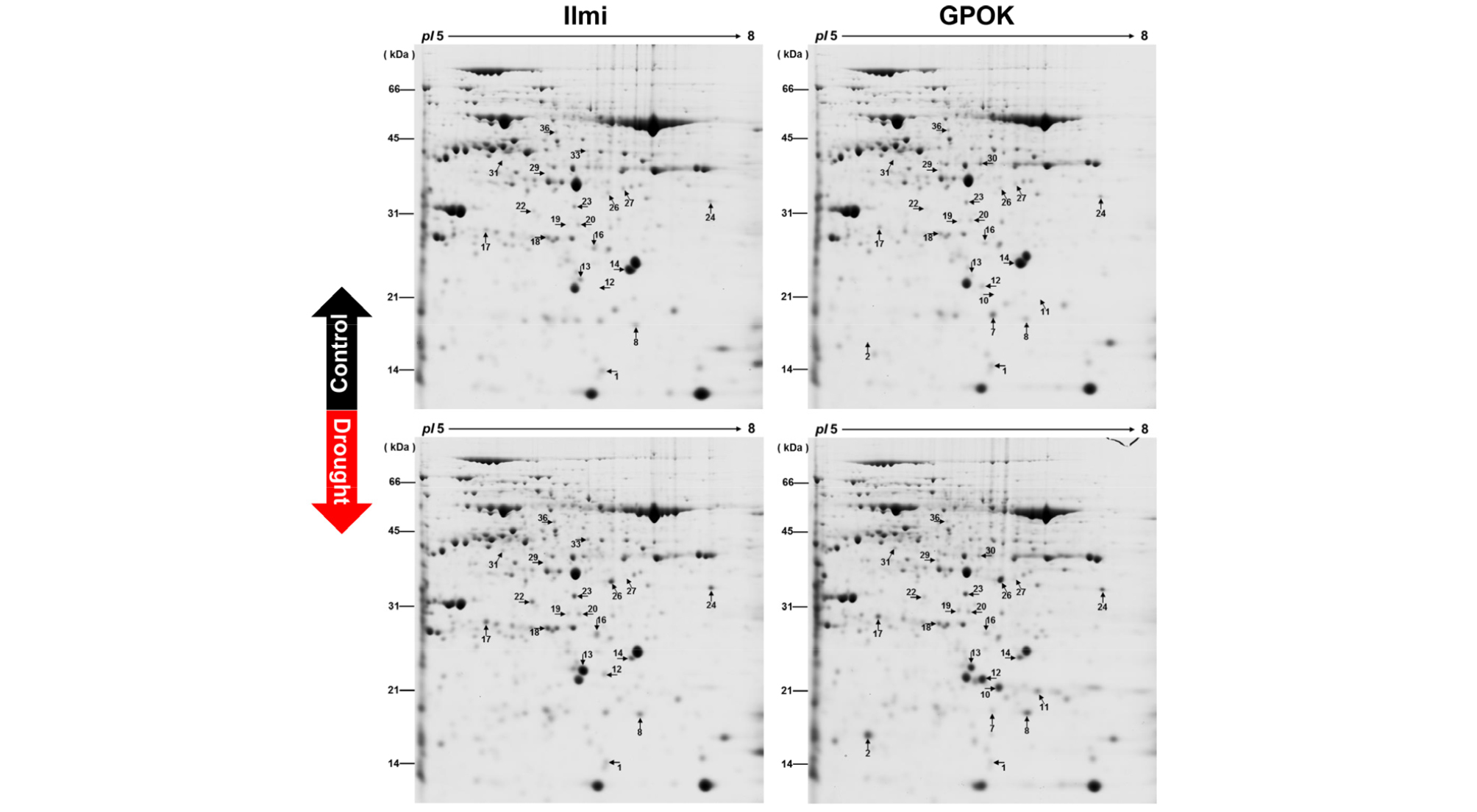
한국 F1 옥수수 교잡종의 수분 부족 스트레스에 따른 반응 메커니즘을 더 잘 이해하기 위해 일미찰과 광평옥의 수분 부족 스트레스를 받은 잎에서 페놀법을 사용하여 단백질을 추출했으며, 이차원전기영동 최적 분해능을 위하여 pH 5-8인 IPG strip을 사용하였다. 이차원전기영동 분석은 3반복을 하였으며, CBB 염색 및 ImageMaster 소프트웨어를 사용하여 대조군과 수분부족처리군과의 비교를 통해서 21 단백질 spot이 서로 다르게 발현되는 것을 확인하였다(Fig. 7). 이들 중 15개 단백질 spots (8, 12, 13, 16, 17, 18, 19, 20, 22, 23, 24, 26, 29, 31, 36)은 수분 부족 스트레스에 의해 일미찰 및 광평옥 옥수수에서 과 발현됨(Fig. 7, Table 1)을, 그리고 3개의 단백질 spots (2, 5, 11)은 광평옥에서만 과 발현 된 것을 확인하였다(Fig. 7, Table 1). 이러한 결과는 옥수수 품종 간 수분 부족 스트레스로 인해 공통적으로 영향을 받는 단백질이 있음과 동시에 품종 특이적 단백질이 있음을 확인하였다.
Table 1. List of differentially accumulated proteins identified by MALDI-TOF MS in Ilmi. and GPOK following 10 days of drought stress at tassel initiation.
이들 단백질 spot은 MALDI-TOF 과정과 Protein Prospector 및 Mascot database를 사용하여 총 21개의 단백질을 동정하였으며, 2, 10, 11번 단백질 spot은 광평옥에서만 동정되었다(Fig. 7, Table 1). 이들을 생물학적 기능별로 분류하여 본 결과 탄수화물 대사에 관련된 단백질은 8개, 스트레스관련 단백질은 6개, 지방산 대사와 광합성 관련 단백질 각각 2개, 그리고 에너지 대사, 수송 관련 단백질, 미확인 단백질이 각 1개씩 확인되었다(Table 1).
일미찰과 광평옥에서 수분 부족 스트레스는 탄수화물 대사에 관련되어 있는 단백질들의 발현에 영향을 주었다. 이들 중 malate dehydrogenase (MDH; spot 12), ribulose- phosphate 3-epimerase (RPE; spot 16), NAD-dependent epimerase/dehydratase (spot 19), peptidyl-prolyl cis-trans isomerase (PPIase; spot 22), alpha-galactosidase (AGA; spot 31)은 일미찰과 광평옥에서 공통적으로 발현량이 증가하였으나, Triosephosphate isomerase (TPI; spot 14), fructose- bisphosphate aldolase (FBA: spot 27)은 감소하였고, lactoylglutathione lyase (spot 2)은 광평옥에서만 특이적으로 발현량이 증가하였다(Table 1). MDH는 탄수화물 합성에 관여하고(Cramer et al., 2013), NAD-dependent epimerase/dehydratase는 보조 인자로 NAD를 사용하고 기질로 핵산당을 이용하여 다양한 화학반응에 대응하는 효소이며, AGA는 raffinose 대사경로에서 중요한 효소로 작용한다. RPE는 Calvin cycle에서 D-ribulose 5-phosphate를 D-xylulose 5- phosphate로 전환시키는 역할을 하며, FBA는 고열, 습해, ABA에 의해서 전사체 발현이 증가하는 것으로 밝혀졌다(Hu et al., 2012).
두 번째 수분 부족의 영향을 많이 받은 단백질 그룹은 스트레스관련 단백질들이다. 총 6개의 스트레스관련 단백질이 동정되었으며, 두 개의 Ascorbate peroxidase (APX; spot 8, 18)와 각각 한 개의 cysteine proteinase inhibitor (CPI; spot 13), harpin binding protein 1 (HrBP1; spot 17), serine/ threonine-protein phosphatase 1 (PP1; spot 23), 그리고 peroxidase 66 (POX; spot 26)은 수분 부족에 따라 일미찰 및 광평옥 모두에서 발현량이 증가함을 확인하였다(Fig. 7, Table 1). 식물은 환경스트레스에 의해 유도되는 활성산소로 인한 피해를 줄이기 위한 진화를 거듭하였다. 가뭄, 염분, 저온 등과 같은 환경조건하에서 활성산소를 감소시키기 위한 APX와 POX의 역할은 많이 연구되었다(Pechanova et al., 2013; Sugihara et al., 2000). 한발 스트레스에 따른 Han21과 Ye478 옥수수 자식계통에서 APX와 POX의 전사체 발현이 증가하였으며(Zheng et al., 2010), CPI는 종자의 성숙과 발아 조절에 관여하고 있으며, 최근 다양한 비생물학적 스트레스 하에서도 전사체 발현이 증가되는 것으로 확인되었다(Li et al., 2015). 최근 연구에서 HrBP는 벼에서 질소 부족에 따른 방어 기작에 관여하여 광합성과 질소 흡수를 강화시키는 것으로 보고되고 있으며(Song et al., 2015), PP1은 세포 스트레스관련 신호전달에 관여하는 것으로 밝혀지고 있다(Uhrig et al., 2013). 이러한 결과는 동정된 스트레스관련 단백질들이 물 부족에 따른 옥수수 생리 변화에 밀접하게 관여한다는 것을 의미한다.
동정된 일부 단백질 중 옥수수 수분 부족에 따른 PPIase, TPI와 에너지 대사에 관련된 mitochondrial ATP synthase, 그리고 수송에 관련된 vacuolar ATP synthase subunit E의 기능적 연구는 아직까지 미미한 편이다. 따라서 이런 단백질들에 대한 기능 연구가 추가적으로 필요로 한다. 또한 본 연구에서 수분부족처리에 특이적으로 발현한 유전자 정보를 활용한 유전자원 간 가뭄 저항성 관련 유전자 발현 비교연구를 통해 분자생물학적 가뭄 저항성 평가지표를 개발할 수 있을 것이다.
적 요
본 연구는 옥수수 유수형성기(본 잎 6개)에 10일 동안 수분부족처리를 하였을 때 F1 옥수수 교잡종 식물체의 생리적 반응과 프로테옴 변화를 분석한 것이다. 실험에 사용한 품종은 일미찰과 광평옥이었다.
1.정상구에 비해 수분이 결핍된 옥수수 교잡종에서는 평균 3개의 잎이 감소했고, 잎 면적은 각각 32~34 % 감소했으며, 경장은 일미찰에서는 약 14%, 광평옥에서는 약 27% 줄었다. 웅수 길이는 일미찰과 광평옥에서 각각 74, 82%가 감소하였다.
2.V4~6 엽기 때 10일간의 수분 결핍 처리는 옥수수의 모든 부분에서 건물중을 감소시켰으며 특히, 줄기의 건물중이 잎과 뿌리보다 훨씬 감소하였다. 일미찰과 광평옥에서 잎과 줄기의 건물중은 각각 약 83%, 73% 감소했으며, 수술 건물중은 각각 약 35, 86% 감소했다.
3.V4~6 엽기 때 10일간의 수분 결핍 처리는 옥수수의 모든 부분에서 건물중을 감소시켰으며 특히, 줄기의 건물중이 잎과 뿌리보다 훨씬 감소하였다. 일미찰과 광평옥에서 잎과 줄기의 건물중은 각각 약 83%, 73% 감소했으며, 수술 건물중은 각각 약 35, 86% 감소했다.
4.이차원전기영동방법으로 정상구와 한발 스트레스를 받은 교잡종에서 다른 단백질 발현양상을 나타내는 21 개의 단백질 spot을 확인하였다. MALDI-TOF MS (matrix assisted laser desorption ionization-time of flight mass spectrometry) 및 단백질 데이터베이스 분석을 통해 21개의 단백질 spot 중 탄수화물 대사에 관련된 단백질이 8개, 스트레스 관련 단백질이 6개, 지방산 이화작용 및 광합성에 관련된 단백질이 각각 2개, 에너지 대사 및 수송에 관련된 단백질이 각각 1개가 분석되었다.
5.이들 단백질 중 Triosephosphate isomerase, fructose- bisphosphate aldolase, uncharacterized protein을 제외하고 한발 스트레스 처리시 일미찰과 광평옥 모두에서 단백질 발현양이 증가하였으며, lactoylglutathione lyase, delta 3,5-delta 2,4-dienoyl-CoA isomerase은 광평옥에서만 과발현되었다.