서 론
재료 및 방법
식물재료 및 담수발아 특성 평가
담수 중 혐기발아 특성 평가
실내검정
포장검정
유망 계통의 작물학적 특성 및 직파 적응성 평가
작물학적 특성 평가
담수직파 적응성 평가
SNP 탐색 및 CAPS 분자표지 개발
통계분석
결과 및 고찰
여교잡 집단 육성 및 작물학적 특성 평가
혐기발아 내성 연관 CAPS 분자표지 개발
56 계통의 작물학적 특성 및 QTL 분포
PYT 계통의 담수직파 초기입모특성 및 작물학적 특성
적 요
서 론
벼는 가장 넓은 지역에서 재배되고 있는 세계 주요3대 작물 중 하나이다(Dokku et al., 2013). 벼는 광범위 지역 및 다양한 기후조건에서 재배가 가능하기 때문에 세계적으로 재배 면적과 소비량이 꾸준히 증가하고 있다(Awika, 2011). 벼의 재배 양식은 파종 방법에 따라 볍씨를 논에 직접 파종하는 직파재배와 볍씨를 육묘한 후 포장에 옮겨 심는 이앙재배로 나눌 수 있다. 직파재배는 이앙재배에 비해 노동력 및 생산비 절감효과가 크기 때문에 전세계적으로 직파재배 면적은 증가하고 있는 추세이다(Pandey & Velasco, 2002; Kumar & Ladha, 2011). 우리나라도 농업인구 고령화와 농업인구 감소에 따른 쌀 생산여건 변화에 대응하고 쌀 생산 농가의 소득증대를 위해서는 직파재배 면적의 확대가 필요하다. 하지만, 현재 국내 직파재배 면적은 전체 벼 재배면적 대비 2~3% 정도로 그 비율이 이앙재배에 비해 매우 낮은 편이다. 현재 국내에서 시행되는 직파재배의 대부분은 무논직파 형태로 이뤄지고 있는데, 무논직파는 경운 및 정지 작업 후 논을 굳힌 후 볍씨를 파종하기 때문에 담수직파에 비해 초기 입모가 안정적이다. 하지만 무논직파는 논 굳히기 등 추가적인 작업 과정이 필요하고 파종일에 기상의 영향을 많이 받기 때문에 담수직파에 비해 노력이 많이 들고 비용 생산비 절감효과도 담수직파에 비해 상대적으로 적은 편이다. 이에 반해 담수직파는 담수 상태의 논에 바로 종자를 파종하므로 작업이 간단하고 노동력 및 생산비 절감효과가 크고, 드론 등을 이용한 항공직파도 가능하여 대규모 영농에 유리한 장점이 있다. 하지만 담수직파는 담수 상태의 논에 종자를 바로 파종하기 때문에 담수상태로 야기되는 혐기조건이 종자의 발아와 입모를 방해함으로써 파종 후 발아가 균일하지 못하고 입모가 불안정해지는 단점이 있다. 특히, 경지정리와 배수 상태가 불량한 경우 이러한 문제는 더욱 악화된다(Ismail et al., 2012; Septiningsih et al., 2013). 따라서 담수직파 시 안정적인 입모를 확보하기 위해서는 담수 상태의 낮은 산소조건에서도 발아와 입모가 균일하고 안정적인 재배가 가능한 담수직파 전용 벼 품종의 개발이 필요하다(Biswas & Yamauchi, 1997a; Kim & Reinke, 2018).
현재까지 국내에서는 이앙 및 직파에 겸용으로 사용이 가능한 ‘수안’(Shin et al., 2013) 등 직파적응성을 가진 다수의 벼 품종이 개발되어 담수직파 재배시 요구되는 저온 발아성, 도복 등의 문제점은 다소 개선이 되었다. 하지만 담수 및 혐기조건에서의 발아 및 입모와 관련 형질의 개선은 미흡한 편이다. 담수직파 전용 품종 개발에서 가장 큰 어려움은 혐기상태에서 발아 및 입모가 우수한 유전자원이 한정되고 저산소 및 담수상태에서 발아 및 초엽의 신장 등에 대한 생리적, 유전적 기작이 분명하게 규명되지 않고 있는데 있다(Biswas & Yamauchi, 1997b; Tuong et al., 2000). 국제미작연구소에서 약 8000개 유전자원에 대하여 담수조건에서의 유묘 생존율을 조사한 결과, 생존율이 70% 이상인 자원이 전체 유전자원 가운데 0.23% 이하였다고 보고하였다(Angaji et al., 2010). 또한 혐기발아 내성 유전자원의 대부분은 인디카형이나 잡초벼에서 유래한 것이 많아 도복, 적미, 탈립 등의 비 선호형질을 가지고 있어 재배벼의 담수직파 재배시 발아 및 초기입모 개선을 위한 교배친으로 바로 이용하는데 여려움이 있다(Seshu et al., 1988; Yamauchi & Winn, 1996; Biswas & Yamauchi, 1997a). 지금까지 벼 혐기발아성과 관련하여 Khao Hlan On, Ma-Zhan Red, Nanhi, Tai Nguyen 등에서 유래한 혐기발아 내성과 연관된 주동 QTL이 탐색 되었다(Angaji et al., 2010; Septiningsih et al., 2013; Baltazar et al., 2014; Kim & Reinke, 2018). 국내에서는 잡초벼 유전자원 PBR과 국내 중만생 고품질 벼 남평과의 교잡을 통해 육성된 RIL집단을 이용하여, 남평에서 유래한 담수 혐기발아성 연관 QTL qAG1과 PBR (Photoblastic rice)에서 유래한 qAG3과 qAG11이 보고 되었다(Jeong et al., 2020). 유전력이 높은 담수 혐기발아 관련 QTL/유전자 도입을 통하여 담수직파 초기 발아 및 입모를 개선함으로써 벼 직파재배 면적의 확대를 기대할 수 있을 것으로 생각된다. 다만, 잡초벼 유래 유용 유전자/QTL 도입시 동반되는 열악형질 영향을 최소화하면서 육종효율을 함께 높이기 위해서는 분자표지를 활용한 기존 품종과의 여교잡(Marker- assisted backcross; MAB)이 필요하다. 본 연구는 잡초벼 PBR에서 유래한 혐기발아 내성 유전자를 국내 자포니카 벼 품종인 남평에 도입하고, 담수직파 시 입모 특성이 기존 품종에 비해 크게 개선된 벼 우량 계통을 육성한 결과이다.
재료 및 방법
식물재료 및 담수발아 특성 평가
국내 자포니카 벼 품종의 담수직파 시 초기 입모 개선을 위하여 혐기 발아성이 우수한 잡초벼 유전자원 PBR과 반복친으로 사용한 중만생 고품질 벼 품종 남평과 여교잡을 통해 육성된 56계통(BC1F5)을 시험재료로 이용하였다. 이들 계통들은 작물학적 특성이 고정된 고세대 계통들로 포장에서 표현형 선발을 통해 선발된 계통들이다.
본 연구에 사용된 시험재료의 작물학적 특성 평가는 2년(2016~2017)간 국립식량과학원 벼 시험포장에서 수행되었다. 종자 파종은 5월 초순을 기준으로 파종하였고 주당 1본씩을 30×15 cm의 재식 밀도로 6월 초순경에 본답에 이앙하였다. 시비량은 9-4.5-5.7 (N-P2O5-K2O) Kg/10 a 기준으로 하였으며 기타 재배법은 농촌진흥청 벼 표준재배법을 따랐다. 작물학적 특성은 농업과학기술 연구조사분석기준(RDA, 2012)을 기준으로 출수기, 간장, 수장, 수수를 조사하였다.
담수 중 혐기발아 특성 평가
시험재료로 사용한 56계통들의 담수초기 입모 특성 평가를 위해 담수 중 혐기발아 특성검정을 국립식량과학원에 소재한 온실(실내)과 시험포장에서 각각 2년간(2016~2017년) 수행하였다(Fig. 1).
실내검정
실내 검정은 평균온도가 21°C로 설정된 온실에서 3반복으로 수행하였다. 종자의 파종은 수도용 플라스틱 파종상자(72공, 72×28×4 cm)에 3 cm 정도의 수도용 상토를 채운 후 계통 당 마른 종자 30립을 3개의 파종 구멍에 각각 10립씩 나누어 파종한 후 1 cm 두께로 복토하였다. 이후 파종 상자를 저수용 수조(길이×너비×깊이; 2.3×1.2×0.3 m)로 옮긴 후 복토한 지점으로부터 수심이 10 cm가 되게 담수 하였다(Fig. 1a). 파종 후 14일과 21일 후 수면위로 초엽이 출현한 개체를 기준으로 각각 생존율을 계산하였다.
포장검정
포장 혐기 발아 내성 검정은 국립식량과학원 벼 시험 포장에서 실시하였다. 종자 파종은 5월말경을 기준으로 하였으며 본답에 이랑(길이 90 cm, 높이 15 cm)을 조성한 후 이랑 위에 10 cm 간격으로 파종골(길이×너비×깊이; 40×1×1 cm)을 만들고 마른 종자 30립을 줄뿌림 하였다. 이후 시험 포장의 논흙을 이용하여 약 1 cm 깊이로 종자를 복토하고 수심 10 cm 깊이로 담수 한 후 시험 종료 시까지 수심을 유지하였다(Fig. 1b). 파종 21 일 후 수면 위로 초엽이 출현한 개체 수를 기준으로 생존율을 계산하였으며, 생존율을 기준으로 달관(1: >80%, 3: 60~80%, 5: 60~40%, 7: 40~20%, 9: <20)으로 평가하였다.
유망 계통의 작물학적 특성 및 직파 적응성 평가
2016년부터 2017년까지 2년간 혐기발아 특성평가 및 포장에서의 작물학적 특성 평가를 통하여 56계통 중 담수발아 특성 및 작물학적 특성이 우수한 5 계통을 선발하였다. 이들 5계통의 담수직파 적응성을 면밀히 검토하고자 생산력 검정 예비 시험(Preliminary Yield Trials; PYT)에 공시하여 수량성, 작물학적 특성과 담수직파 적응성을 검토하였다.
작물학적 특성 평가
작물학적 특성 평가를 위해 종자는 4월30일 파종하였고 주당 3본을 기준으로 30×15 cm의 재식밀도로 5월25일에 본답에 이앙하였다. 시험구는 2반복으로 임의 배치하였다. 기타 재배법 및 포장 관리는 포장 특성 평가와 동일하게 간장, 수장, 수수 등 주요 작물학적 특성을 조사하였다. 수량성 평가는 포장 반복구에서 100주를 수확한 후 탈곡하고 수분함량을 15%로 보정하여 10 a당 쌀 수량(Kg)으로 환산하였다.
담수직파 적응성 평가
생산력 검정 예비 시험에 공시 된 5계통에 대해 담수 직파 적응성을 평가하였다. 종자의 파종은 2018년 5월 15일 국립식량과학원 시험포장에서 실시하였다. 담수직파 적응성 평가를 위한 시험포장은 파종 7일전 기비를 시용한 후 정지작업을 실시하고 물을 약 10 cm 깊이로 담수 하였다. 종자 파종 3일전부터는 담수 깊이가 약 1 cm 이하가 되도록 담수 된 물을 배수한 후 파종일까지 유지하였다. 종자 준비는 프로라츠유제 1/2000 희석액을 이용하여 소독한 후 싹이 1~2 mm 정도로 균일하게 나올 때까지 30°C의 물에 침종하였다. 이후 최아 된 종자를 계통 당 25.2 g의 양으로 6.3(1.8×3.5) m2 크기의 시험구에 균일하게 산파하였다. 담수 중 입모율 비교를 위해 담수직파 적응성이 양호한 동안과 반복친인 남평을 체크품종으로 함께 공시하였다. 파종 후 약 7일간은 벼 입모를 위해 눈그누기를 하였으며 이후 10 cm 깊이로 담수하였다. 입모율 조사는 파종 후 30일경 입모 정도를 체크품종과 비교하였다.
SNP 탐색 및 CAPS 분자표지 개발
혐기발아 내성 QTLs (qAG1, qAG3, qAG11)의 도입여부를 판단하기 위해 Agarose gel 상에서도 운용이 가능하도록 cleaved amplified polymorphic sequences (CAPS) 분자 표지를 개발하였다. 양친인 남평과 PBR에 대하여 생물정보 분석업체 마크로젠(Seoul, Korea)에 의뢰하여 차세대 염기서열 분석(next-generation sequence, NGS)을 수행하였다. 이후 Rice SNP-miner 프로그램(C-2016-028268)을 이용하여 해당 QTL 영역에서 양친에 대해 다형성을 보이는 SNP들을 탐색하고 SNP 주변 약 800 bp 정도를 증폭할 수 있도록 염기서열 정보를 바탕으로 primer set을 제작하였다. 이후 PCR 반응을 통하여 증폭 여부를 확인한 뒤 제한 효소로 처리하여 다형성을 판단하였다. PCR 조성은 2 μl gDNA, 1.0 μl 10 × PCR buffer, 0.2 μl dNTP mixture, 0.5 U Taq polymerase (Inclone, Korea)조건이며, PCR반응은 Gene Touch- Gradient (BIOER, China)을 이용하여 수행하였다. PCR 조건은 95°C에서 5분간 초기 변성시키고, 95°C에서 30초, annealing 온도는 primer에 따라 58~68°C에서 40초, 72°C에서 40초 과정을 35회 반복 후 72°C에서 8분간 반응시켰다. 생성된 PCR product 10 μl에 제한효소 0.2 μl, buffer 2 μl, dH2O 2 μl을 넣은 후 제한효소 제조사에서 제공하는 protocol에서 제시한 온도 및 시간을 준수하여 제한효소 처리 후 2.0% agarose gel에서 다형성을 확인하였다.
통계분석
통계분석은 SAS 프로그램(Version 9.4, Enterprise Guide 7.1, SAS Institute Inc, Cary, NC, USA)을 이용하여 공시재료의 분석 형질에 대한 평균을 기술 통계법으로 구하였고 유의성 검정은 t-test와 Duncan의 다중 평균비교 방법에 의해 p<0.05 수준에서 유의적 차이를 검정하였다.
결과 및 고찰
여교잡 집단 육성 및 작물학적 특성 평가
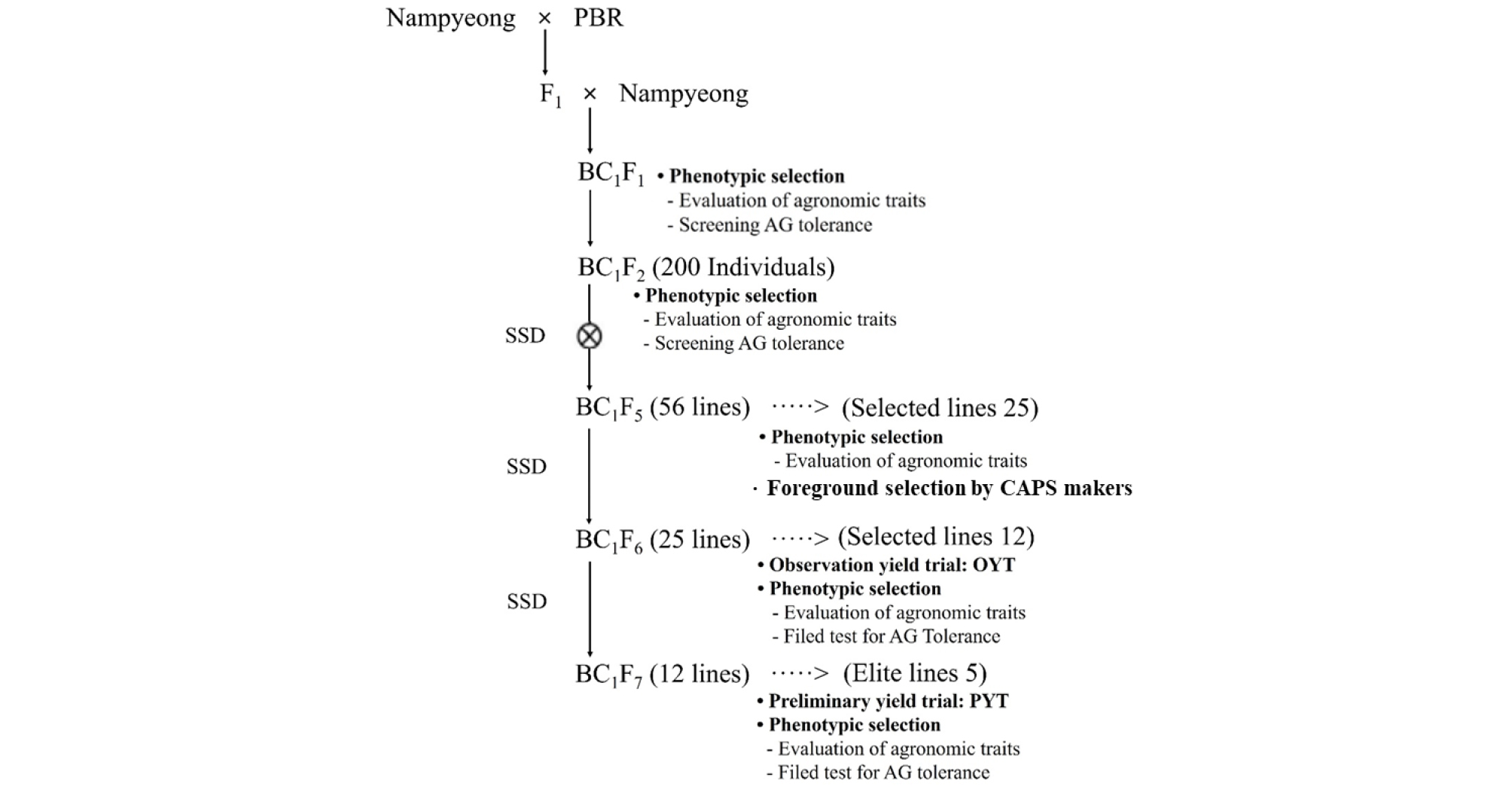
남평과 PBR 유래 여교잡 집단의 계통 육성 및 선발 과정은 Fig. 2와 같다. 남평과 PBR 간 교잡을 통해 확보한 F1 식물체와 반복친(남평)간 여교잡을 통해 얻은 BC1F1 교배립을 포장에 전개하고 이들로부터 BC1F2 종자를 수확하였다. BC1F2 세대에서 작물학적 특성이 남평과 유사하다고 판단되는 200개체를 선발하고 BC1F5 세대까지는 일주일계통법(single seed decent)으로 세대 진전시켰다. 이후 표현형 선발을 통해 작물학적 특성이 양호한 56계통(BC1F5)을 선발하였다. 2016~2017년 동안 56계통을 시험포장에 전개하여 작물학적 특성을 평가하고 혐기발아 검정 및 MAS 결과를 고려하여 F6 세대에서 25계통, F7에서 12계통을 각각 선발하였다. 최종적으로 이들 계통 중 작물학적 특성이 우수하면서 혐기발아 내성이 우수한 5계통을 선발하여 PYT에 공시하였다.
혐기발아 내성 연관 CAPS 분자표지 개발
남평과 PBR에 대한 NGS분석을 통하여 각각 3개의 목표 QTL (qAG1, AG3, AG11) 영역내에서 양친간 다형성을 나타내는 SNP를 탐지하고, 이들 SNP를 PCR 및 전기영동 기반에서 구분이 가능하도록 CAPS 분자표지를 개발하였다(Supplementary Table 1). qAG1의 Flanking 영역인 1번 염색체 25.0~25.4Mb에서 양친에 다형성을 나타내는 SNP 부위를 탐색하고, 이들을 이용하여 30개의 primer set를 개발했다. 그 중 양친 간의 다형이 확인된 14개 CAPS 분자표지 세트를 선발했다. 다형을 보인 14개 primer 세트 중 구별성이 가장 좋았던 np01.104/PstI을 qAG1 판별을 위한 분자표지로 최종 선발하였다(Table 1). 동일한 과정을 통해 qAG3와 qAG11에 대한 CAPS마커를 제작하였다. 염색체 3번과 11번의 qAG3와 qAG11 영역에서 각각 18개와 17개의 CAPS 분자표지 세트가 제작되었으며, 양친 검정을 통해 7개와 9개 세트가 각각 qAG3와 qAG11에 대한 분자표지로 선발되었다(Supplementary Table 1). 다형을 보인 선발 분자표지 중 구별성이 가장 좋았던 np03.077/XhoI과 np11.091/PstI이 혐기발아 내성 계통 선발을 위한 분자표지로 최종 선택하였다(Table 1). 목표형질 연관 유전자 혹은 QTL과 밀접하게 연관된 분자표지는 복수의 유전자를 집적하거나 양적유전자를 도입하여 형질을 개량하는데 매우 효과적인 육종 방법이다(Singh et al., 2001; Perez et al., 2008; Sundaram et al., 2008; Pradhan et al., 2015). 한편, MAS (marker-assisted selection)를 효과적으로 육종에 이용하기 위해서는 이용 분자표지가 목표형질과 가깝게 연관되어 있어야 하며, 대립인자에 대한 구별성과 다형 확인이 용이해야 한다. 본 연구에서 개발된 CAPS 분자표지 형태의 QTL 마커들은 목표형질인 직파적응성 품종 개발을 위한 혐기발아 내성 계통 선발에 유용하게 이용될 것으로 사료된다.
Table 1.
List of cleaved amplified polymorphic sequences markers converted and used for foreground selection of breeding lines.
56 계통의 작물학적 특성 및 QTL 분포
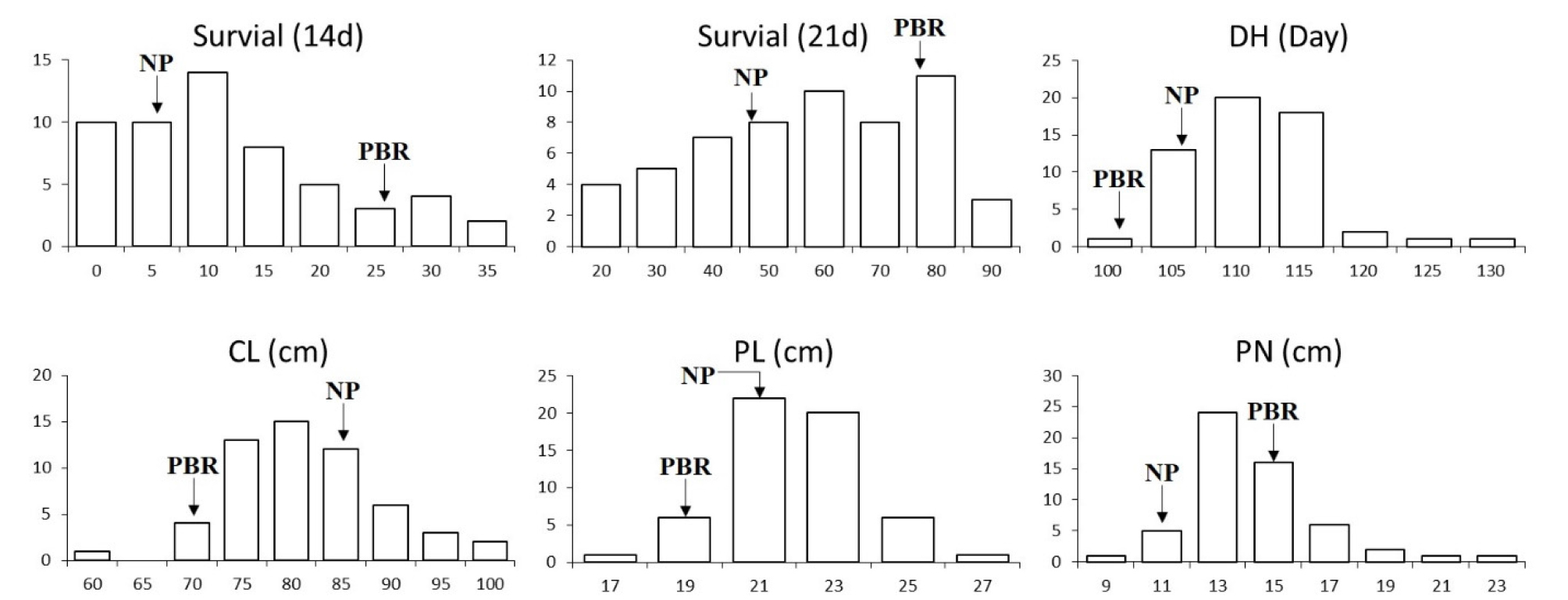
혐기발아 내성 및 작물학적 특성 등을 고려하여 BC1F5세대에서 총 56계통을 선발하여 출수기 등 주요 작물학적 특성을 조사하였다(Fig. 3). 출수일수는 평균 109일이었으며 100~130일 범위에서 조사되었다. 간장 및 수장은 평균 86 cm와 21 cm였으며, 각각 60~104 cm, 17~27 cm 범위에서 조사되었다. 수수는 평균 14개이었으며 양친이 포함된 9~23개 범위에서 분포하였다. 교배 후 선발과정에서 출수일수는 양친보다 길어지는 경향이었으며 간장, 수장, 수수는 대체로 양친의 조사값을 기준으로 정규분포 하였다.
선발된 56계통에 대한 QTL 도입 여부를 확인하기 위하여 개발된 CAPS 분자표지를 이용해서 foreground 선발을 실시하였다(Fig. 4). 3개의 QTL 모두를 포함하는 계통은 총 5개이었으며, 2개의 QTL을 포함하는 계통은 30계통, qAG1 혹은 qAG3 등 단일 QTL만을 보유한 계통은 각각 9계통과 7계통이였다. QTL이 없는 계통도 5개가 확인되었다(Table 2).
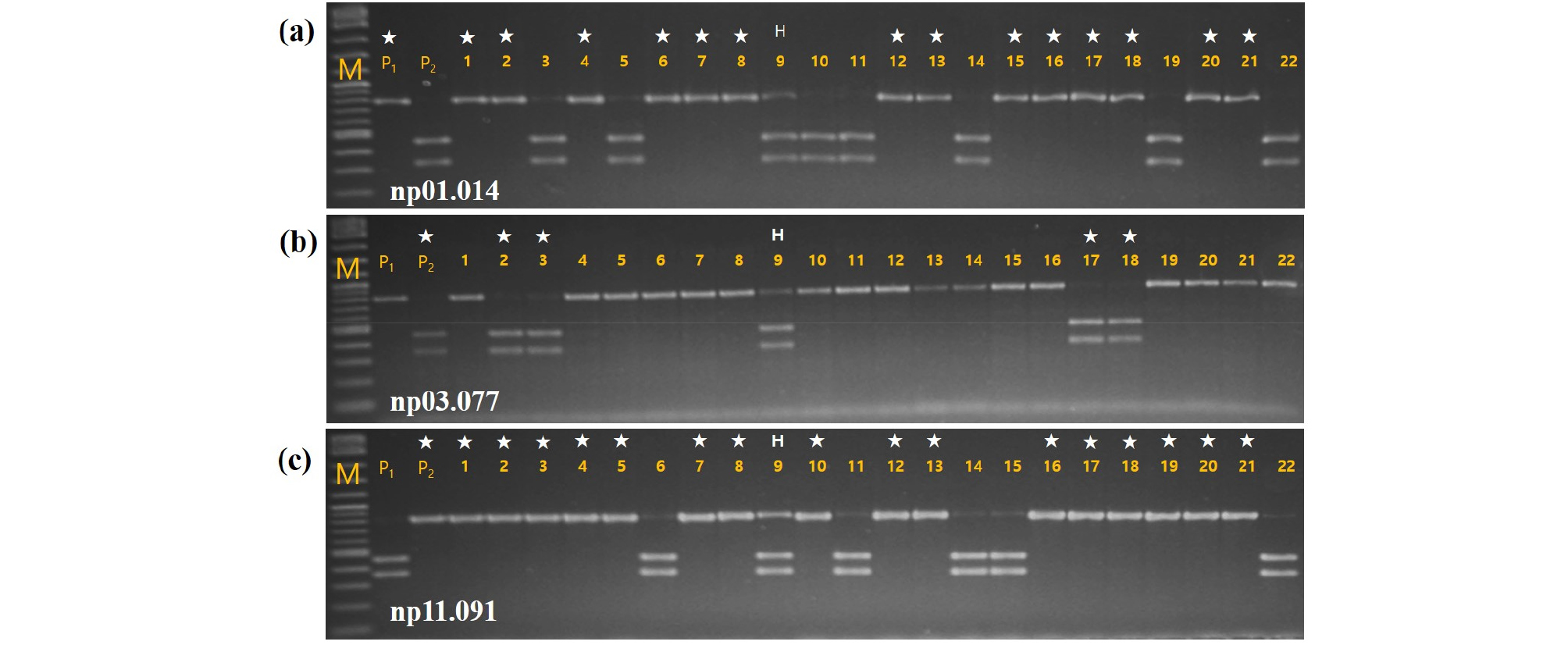
Fig. 4.
PCR analysis to confirm qAG1, qAG3, and qAG11 in the breeding lines using three converted cleaved amplified polymorphic sequences markers. (a) shows band patterns digested with the PstI restrict enzyme, using the PCR products amplified by the np01.014 primer set. (b) and (c) also indicate band patterns digested with XhoI and PstI, respectively, using PCR products by each of tested markers (np03.077 and np11.091). For qAG1, the QTL is validated in lanes 3, 4, 6, 8-10, 14, 15, 17-20, and 22-23. For qAG3, progeny with the QTL are lanes 4, 5, 11, 19, 20, and 21. For qAG11, progeny with the QTL are lines 2–7, 9-10, 12, 14-15, and 18. Lane M is a size marker. The number on the lane indicates the no. of progeny and the star mark indicates the line with the favorable QTL allele.
Table 2.
Anaerobic germination tolerance and agronomic traits of 56 lines classified according to QTL combination.
Ducan 분석 결과 QTL 집적 개수에 따른 담수 중 유묘 생존율은 서로 유의한 차이를 나타내었다. 유묘 생존율은 3개의 QTL이 모두 집적된 QTL combination (QC)1에서 가장 높게 나타났는데, 2주 및 3주 후 실내 생존율은 각각 24.5%와 75.6%였다. 다음으로 QC2와 QC3가 생존율이 우수한 것으로 조사되었다(Table 2). 이러한 결과는 세 개의 QTL이 모두 포함된 조합과 qAG1와 qAG11이 동시에 포함된 조합에서 생존율이 유의하게 높게 나타난다는 기존의 실험결과(Jeong et al., 2020)와 동일한 것이다. 이 결과는 도입된 AG QTLs의 작용에 의해 육성 계통들의 담수발아 특성이 개선됨으로써, 담수 환경에서 벼의 초기 입모와 관련하여 이들 QTL 조합이 실제 효과가 있음을 의미한다. 한편, 혐기발아 내성 연관 QTL들을 집적함으로써 다른 형질들의 변화를 관찰한 결과, 간장과 수장 등 주요 농업 형질의 변이는 관찰되지 않았으나 출수일수에서 QC 조합에 따라 통계적으로 유의한 차이를 나타내었다(Table 2).
PYT 계통의 담수직파 초기입모특성 및 작물학적 특성
생산력 검정 예비 시험(PYT)에 공시된 5계통에 대한 분자표지 검정결과, 세 계통(28707, 28708, 28710)은 QC1 (qAG1+ qAG3+qAG11) 조합이었으며, 나머지 두 계통(28709, 28711)은 QC2 (qAG1+qAG11) 조합인 것으로 확인되었다. 이들 5 계통의 담수 직파 유묘 생존율을 확인하기 위하여 온실 및 포장에서 담수 발아 실험을 수행하였다(Table 3). 선발된 계통들은 온실 담수 조건에서 파종 후 2주 및 파종 후 3주 유묘 생존율은 각각 22.2~31.3%와 66.7~84.4%로 반복친인 남평과 담수직파 적응성 체크 품종인 동안(13.6%, 26.5%)보다 유묘 생존율이 유의하게 높은 것으로 조사되었다. 선발 계통은 포장 담수 조건에서 모두 반복친인 남평보다 높은 유묘 생존율을 나타냈는데 특히, 3개의 QTL이 모두 집적된 QC1 조합(1.7~3.0)은 2개의 QTL이 집적된 QC2조합(4.0~5.0)보다 포장조건에서 높은 생존율을 나타내었다. 이는 2개의 QTL이 집적된 계통은 온도가 일정한 실내의 담수환경에서는 높은 발아율을 나타내지만, 온도 변화가 심한 실외의 포장 조건에서는 qAG3이 집적된 계통이 더 안정적인 것임을 의미한다. Kim et al. (2006)에 따르면 담수 직파 재배는 발아와 입모기간 동안 저온과 담수로 인한 혐기 상태에 동시에 노출되기 때문에 입모의 안정성을 높이기 위해서는 저산소 및 저온에서도 발아와 초엽의 신장이 양호해야 한다고 하였는데 QC1 조합은 실내 및 실외 조건 모두에서 체크 품종(동안) 보다 안정적인 유묘 생존율을 나타낸 것으로 조사되어 2개의 QTL이 조합된 QC2 조합보다는 담수직파 초기 입모율 안정성을 높이는데 유리할 것으로 생각된다.
Table 3.
Survival rates of five selected lines in preliminary yield trials under flooding conditions in greenhouse and field.
본 실험에서는 선발 계통의 유묘 생존율이 14DAS (Days after sowing) 이후 일주일간 3배이상 증가하였는데 이는 일반적인 저항성 품종이 7DAS 이후에 유묘 생존율이 크게 증가하여 14DAS가 지난 후에는 그 변화가 크지 않은 담수 회피 전략과는 다소 차이가 있었다(data not shown). 기존의 보고에 따르면 혐기발아 내성 자원은 저산소 조건에서는 종자전분을 에너지원으로 사용하여 초엽의 성장 속도를 빠르게 함으로써 담수환경을 단기에 회피하는 것으로 알려져 있다(Al-Ani et al., 1985; Magneschi & Perata, 2009). 이러한 현상은 혐기발아 저항성 자원들에서 쉽게 확인되는데, 국내 직파 적응 품종들의 경우 저산소 조건에서 생육을 최대한 억제하여 견디다가 높은 확률로 일시에 담수환경을 회피하는 경향을 보여 불량환경 회피에 있어 다른 양상을 보였다. 담수환경 회피 시점이 생육온도에 따라 표준화된 검정기간(21DAS) 이후에 일어날 경우, 기존 검정법에 의한 저항성 판별에 어려움이 있게 된다. 인디카와 자포니카 벼는 서로 다른 담수환경 회피 전략을 채택하고 있는 것으로 보이는데, 본 연구에서 선발된 계통의 경우 저항성 원이 잡초벼이지만 자포니카 형이고 유전적 배경도 남평이기 때문에 14DAS 이후에 유묘 생존율이 크게 증가되었던 것으로 사료된다. 따라서 차후 벼 생태형간 저산소 회피 전략에 대한 추가 연구가 필요할 것으로 보인다.
생산력 검정 5계통에 대한 주요 농업특성 및 수량구성 요소를 조사하였다(Table 4). 출수일수는 남평이 108일이고, 선발 계통들은 107~112일 사이에서 조사되었다. 간장은 선발 계통들이 평균 73 cm로 남평 대비 다소 증가한 경향이었고, 수장과 수수는 반복친과 선발 계통 사이에 큰 차이가 없었다. 수당립수는 남평이 많았으나 임실률은 선발계통에서 전반적으로 높았으며, 천립중 역시 28711 계통을 제외하면 대부분의 선발 계통이 남평과 비슷하거나 약간 큰 것으로 나타났다. 수량성은 28708과 28009 계통이 남평보다 7~8% 생산량이 높은 것으로 확인되었다. 포장과 온실에서의 담수 발아율, 생육 특성 및 생산량 등을 감안하여 담수 발아율과 작물학적 특성이 가장 우수하였던 28708을 최종 선발하여 전주643호로 계통명을 부여하였다. 전주643호는 세개의 QTL이 모두 도입된 계통으로 담수 직파 시 남평과 직파 적응 품종인 동안에 비해 종자의 발아와 유묘 입모율이 월등하게 높았으며 생존율 역시 100% 이상 향상됐다(Fig. 5) 초형 등 작물학적 특성 및 종자 외관 특성 등도 양호하였다(Fig. 6). 본 연구에서 육성된 전주643호는 담수 직파 적성이 우수한 자포니카 벼 계통으로 국내 직파 재배, 특히 담수직파재배 면적 증대를 유용한 자포니카 계통으로 이용성이 클 것으로 판단된다.
Table 4.
Major agronomic and yield-related traits of the five selected lines.

Fig. 5.
View of seedlings established by direct seeding. (a) indicates the anaerobic germination tolerance of the five selected lines upon checking the cultivars’ responses to flooding condition in the paddy field and (b) performance of Jeonju643 seedlings under the same flooding conditions in the paddy field in Jeonju.
적 요
본 연구에서는 국내 벼 직파재배 활성화 및 재배면적 확대를 위하여 담수발아 관련 QTLs 단편이 이입된 자포니카형 우량 계통을 육성하였다. 더불어 담수 중 혐기발아 내성과 관련 분자표지를 개발하였으며, 이를 우량계통 선발에 직접 활용하였다. 인공교배를 통해 국내 자포니카 잡초벼인 PBR을 수여친으로 남평을 반복친으로 여교잡을 수행하였으며, 이 조합으로부터 담수 혐기 발아성이 개선된 자포니카 형 우량계통을 육성하였다. 그리고 혐기 발아 내성 관련 QTL 판별을 위한 CAPS 분자표지(NP01.014, NP03.077, NP11.091)를 개발하였다. 여교잡 집단을 육성하고, 작물학적 특성, 담수저항성 검정 등의 표현형 선발과 분자표지 선발을 통해 주요 농업형질, 담수 혐기 발아성이 양호한 5계통이 최종 선발되었으며, 이들 계통은 모두 QC1 혹은 QC2 조합으로 남평에 비해 온실에서 평균 2.3배, 포장에서 2.6배 가량 유묘 생존율이 개선된 것으로 나타났다. 선발된 5계통에 대한 생산력 검정 예비시험(PYT), 주요 작물학적 특성 및 담수 혐기 발아성 등의 검정을 통해 28708을 담수직파 우량계통으로 최종 선발하고 ‘전주643호’로 계통명을 부여하였다.