서언
재료 및 방법
식물 재료
ABA 농도에 따른 발아 특성의 조사
ABA 처리구에서 발아한 종자의 배아 내 ABA 함량
배아의 단백질체 분석
통계분석
결과 및 고찰
ABA 농도에 따른 발아 특성
ABA 처리 배아의 ABA 함량
ABA 농도에 따른 배아의 단백질체 특성
적요
서언
밀은 전 세계적으로 재배되고 있는 가장 중요한 작물 중의 하나이고, 세계인구 40% 이상의 주요 식량 자원이다(Shewry, 2009). 종자 휴면은 유리한 조건에서 손상되지 않은 살아있는 종자의 발아를 막는 적응 형질인데(Hihorst, 1995), 밀은 신속하고 균일한 발아를 얻기 위해 종자의 휴면이 약한 자원이 선택되는데, 이로 인하여 수확 전에 습한 조건에서 발아하는 수발아에 대한 감수성이 증가한다(Simpson, 1990).
밀의 휴면성은 종자의 배아에 생장 억제 호르몬의 일종인 abscisic acid (ABA)를 처리했을 때 나타나는 발아 억제현상과 관련이 깊은 것으로 알려져 있다(Walker-Simmons, 1987). 휴면 타파를 촉진시키는 처리들은 종자 내의 호르몬 함량과 민감성 변화와 관련된다. 밀에서의 호르몬 관련 변화 및 휴면 소거를 유발하는 후숙은 ABA와 indole acetic acid (IAA)에 대한 종자의 감수성의 감소와 관련이 있다(Liu et al., 2013). ABA는 저농도에서 종자의 휴면을 적극적으로 유도하고 종자의 발아를 억제하는 식물호르몬이다(Kucera et al., 2005; Yu et al., 2016). 종자는 발아 과정에서 ABA 함량과 ABA 민감성에 영향을 받고, ABA는 배아의 세포벽 이완을 방지하여 수분흡수를 억제할 뿐만 아니라 배아 부위 종피보다는 배유의 파열을 특이적으로 억제한다(Müller et al., 2006). 밀 종자의 ABA 민감성은 배아보다 배아 이외의 부분에서 더 크고(Mares, 1998), 유전자원에 따라서도 차이가 있다(Nyachiro et al., 2002).
종자의 발아와 휴면 등은 유전적 및 환경적 요인의 영향에 의해 생성된 다양한 종류의 단백질들에 의해 표현되고 조절되는 생리적 현상이다. 따라서 다수 다종의 단백질들의 집단(단백질체, proteome)을 분석하면 다양한 생리적 현상의 인과관계를 이해하는데 필요한 정보를 얻을 수 있다(Bove et al., 2005). 단백질체 분석의 가장 기본적인 방법인 이차원젤 전기영동(two dimensional gel electrophoresis, 2DGE)을 이용하면 단백질체의 생성과 분해 등 경시적 변화 경향을 파악하고 이를 바탕으로 단백질체와 생리적 특성과의 관계를 추론하여 이해할 수 있다. 벼 및 다른 식물에서 GA- 및 ABA-반응성 단백질을 분석하는 데에도 2-DE이 효과적으로 이용되었다(Tanaka et al., 2004; Pawlowski, 2007). 그 결과 벼 종자의 초기 발달 과정에서 대사관련 효소(fructokinases), 산소-무독화효소(glutathione-S-transferase, ascorbate peroxidase), 구조 단백질(b-expansin, caffedoyl-CoA 3-O-methyltransferase), 방어 단백질(ABA-induced protein, OsIFR, OsPR10) 및 신호 단백질(nucleoside-diphosphate kinases, NDPK) 등이 ABA와 GA에 의해서 극적으로 조절되는 것을 확인하였다(Kim et al., 2008).
ABA는 밀 종자의 휴면과 발아에 영향을 주는 중요한 호르몬이지만, 발아 과정 중에 배아에서 ABA와 반응하여 어떤 단백질이 증가하거나 감소하는지에 대한 연구는 거의 없다. 따라서 본 연구는 ABA가 밀에서 발아와 발아 종자의 배아 내의 단백질체 발현에 미치는 영향을 조사하고 생리적 특성을 이해하고자 수행하였다.
재료 및 방법
식물 재료
한국의 밀 품종 중에서 발아지수가 각각 0.94, 0.61, 및 0.07로서 종자 휴면성의 차이가 큰 백중밀, 금강밀 및 우리밀을 시험재료로 이용하여 후숙한 종자의 발아와 발아 종자 중의 단백질체 발현에 미치는 abscisic acid (ABA)의 영향을 조사하였다. 시험 재료로 이용된 3품종의 밀은 전라북도 완주군 소재 농촌진흥청 국립식량과학원 밭작물 시험포장에서 농촌진흥청의 맥류 표준재배법에 준하여 재배하였다. 종자는 2015년 10월 중순에 파종하였고, 성숙한 종자는 2016년 6월에 수확하였다. 수확한 종자는 상온의 실험실에서 보관하여 후숙시켰고 당해 연도 11월에 시험에 사용하였다.
ABA 농도에 따른 발아 특성의 조사
성숙한 밀 종자와 배아는 ABA 민감성에 따라 50 μM ABA에서 발아율이 각각 약 30%와 약 90%로 큰 차이를 보이므로(Walker-Simmons, 1987), 본 시험은 0, 10, 30 및 50 μM ABA에서 발아와 관련된 특성을 조사하였다.
선발된 밀 품종 종자의 ABA 농도에 따른 발아지수와 발아율은 반복당 종자 30립씩 6반복으로 조사하였다. 일회용 발아접시(직경 100 mm × 높이 15 mm)에 여과지 1장을 깔고 종구를 아래로 향하도록 종자를 치상한 다음, 0, 10, 30 및 50 μM의 ABA (s-(+)-abscisic acid, Tokyo Chemical) 용액을 5 ㎖씩 첨가하여 뚜껑이 열리지 않도록 점착 테이프로 밀봉하였다. 발아접시를 20℃의 암조건에서 7일 동안 정치시키면서 발아율 등을 조사하였으며, 균류와 세균으로 오염된 종자는 조사에서 제외하였다(Kim et al., 2012). 발아지수는 아래와 같이 측정하였다.

여기에서 N1, N2, N3, N4, N5, N6과 N7은 각 일자에 발아된 종자립수를 나타낸다. 즉, 종자가 조사 1일째에 모두 발아했을 경우의 발아지수는 1로서 최고치를 나타내며, 7일째에도 발아된 종자가 없는 경우의 발아지수는 0으로 최저치를 나타내게 된다(Reddy et al. 1985; Kim et al., 2012). 유아 및 유근 길이는 20℃에서 암조건으로 7일 동안 발아한 균일한 유묘를 선별하여 조사하였다.
ABA 처리구에서 발아한 종자의 배아 내 ABA 함량
20℃의 암조건에서 0 μM 또는 50 μM ABA로 7일 동안 배양하여 발아한 종자를 채취하여 –80℃에서 보관하였다. 발아한 종자는 동결건조 시키고 유근과 유아를 제거하여 배아를 적출하였다. 적출된 배아는 즉시 액체질소를 이용하여 마쇄하고 –80℃에 보관하였다. 건조한 배아 분말 0.01 g에 메탄올 1 ㎖ (0.45mM butylated hydroxytoluene와 2.38 mM citric acid monohydrate가 함유됨)을 첨가하여 4℃에서 교반하면서 약 16시간 동안 추출하였다. 추출액을 2,000 g로 원심분리하여 얻은 상징액을 취하여 메탄올과 증류수가 제거될 때까지 농축시켰다. 농축된 추출액은 10% 메탄올 1 ㎖에 재현탁시켜 ABA 측정용 시료로 이용하였다. ABA 함량은 Phytodetek ABA Test Kit (Agdia)를 이용하여 405 ㎚에서 측정된 흡광도를 이용하여 조사하였다(Walker-Simmons, 1987).
배아의 단백질체 분석
밀 종자를 20℃의 암조건에서 0 μM 또는 50 μM ABA로 4일 동안 발아시킨 후 생장이 균일한 유묘를 채취하여 -80℃에 보관하였다. 채취된 발아 종자를 동결건조하고 유아와 유근을 제거한 다음 배아를 적출하고 액체질소로 마쇄하여 약 100 mg의 분말시료를 준비하여 단백질 추출용 시료로 이용하였다. 각각의 시료는 trichloroacetic acid (TCA)/acetone extraction buffer[10% TCA, 0.07% 2-mercaptoethanol]를 이용하여 –20℃에서 1시간동안 배양하면서 단백질 이외의 불순물을 제거하였다. 펠렛 상태의 단백질을 wash buffer [0.07% 2-mercaptoethanol, 2 mM ethylenediaminetetraacetic acid (EDTA), EDTA-free proteinase inhibitor]를 이용하여 정제하였고, 펠렛을 상온에서 30분 이내로 건조시켰다. 펠렛 상태의 단백질을 lysis buffer[LBTT: 7 M urea, 2 M thiourea, 4% CHAPS, 18 mM Tris-HCl (pH 8.0), 14 mM Tris, 0.2% Triton X-100, EDTA-free proteinase inhibitor, 50 mM dithiothreitol (DTT)]로 용해시켰으며, 원심분리하여 얻은 상징액을 2DGE용 단백질 시료로 사용하였다. 시료는 ProteoExtractTM Protein Precipitation Kit (Calbiochem)을 이용하여 다시 정제하였고, 2-D Quant Kit (GE Healthcare)로 단백질 농도를 측정하였다(Kim et al., 2012).
추출된 단백질체는 2DGE 방법을 이용하여 젤 내에서 공간적으로 분리시켰다(Westermeier et al., 2008). 단백질을 1차원적으로 분리시키는 등전점 전기영동(isoelectric focusing, IEF)은 IPG (immobilized pH gradient, pH 4-7, 24 ㎝) strip gel을 이용하여 실시하였다. IPG strip gel은 상온에서 15시간 동안 단백질 추출액이 포함된 용액(2.0% IPG buffer)으로 재수화시켰다. IPG strip gel에 부하된 단백질의 IEF는 IPGphor unit (GE-Healthcare)을 이용하여 수행하였으며 최종 70,000 Vh가 되도록 설정하였다.
IPG strip은 1% DTT를 함유한 equilibration buffer (50 mM Tris-HCl, 6 M urea, 30% glycerol, 2% SDS)로 15분간 처리한 후, 이어서 2.5% iodoacetamide가 함유된 equilibration buffer로 15분간 처리하였다. 이후 단백질 2차 분리과정인 변성 폴리아크릴아미드젤 전기영동(sodium dodecylsulfate- polyacrylamide gel electrophoresis, SDS-PAGE)은 분리용 젤(DALT VI, GE-Healthcare, 12.5% gel)을 이용하여 12℃에서 1시간동안 1.5 W/gel로 전기영동한 이후 5시간동안 10 W/gel로 유지하여 수행하였다. 2DGE가 완료된 젤의 단백질 spot은 coomassie brilliant blue (CBB) R-250을 사용하여 염색하였으며, 염색된 2DGE 젤을 스캐닝하여 TIFF 파일로 저장하였다. 2DGE 젤의 단백질 spot에 대한 양적 분석은 ImageMaster 2D platinum software (ver. 7.0, GE- Healthcare)를 사용하여 실시하였다. 단백질 spot의 상대값(% volume)은 전체 단백질 spot의 발현양에 대한 개별 단백질 spot의 발현양으로 계산하였으며, 독립적으로 작성된 젤 이미지를 1반복으로 하여 3회 반복 수행하였다. 단백질 spot에 대한 양적 분석결과, 0 μM ABA와 비교하여 50 μM ABA 처리에서 단백질 발현양이 0.8배 이하로 감소하거나 1.2배 이상으로 증가한 단백질 spot을 선정하여 질량분석 및 동정을 수행하였다.
단리된 단백질의 질량은 트립신으로 분해시켜 얻은 펩티드를 이용하여 결정하였다(Shevchenko et al., 2007). 단백질 spot은 젤에서 분리한 이후에 30% 메탄올로 2회 세척하고, 50% acetonitrile과 10 mM NH4HCO3로 불순물을 제거시켰다. 젤 조각은 100% acetonitrile로 탈수시킨 이후 건조시켰다. 젤은 50 mM NH4HCO3에서 100 ng/μL 트립신을 이용하여 재수화시켰고, 37℃에서 약 16시간 분해시켰다. 트립신 펩티드는 50 mM NH4HCO3와 0.1% trifluoroacetic acid (TFA)를 함유한 50% acetonitrile에서 추출하여 질량을 분석하였다.
질량분석은 한국기초과학지원연구원의 MALDI TOF/TOF mass spectrometer와 LC/ESI ion Trap mass spectrometer로 수행하였고, 단백질 spot별 MS spectrum 정보는 MASCOT 소프트웨어(Matrix Science, London, U.K.)를 이용하여 NCBInr과 SwissProt의 식물 단백질 database에서 검색하였다.
통계분석
통계분석은 R (3.4.1) 프로그램을 이용하여 성적의 분산분석(ANOVA)과 T-검정(T-test)을 실시하고 처리평균간 유의성을 검정하였다. 처리평균간 유의성은 Duncan’s multiple range test로 검정하였다.
결과 및 고찰
ABA 농도에 따른 발아 특성
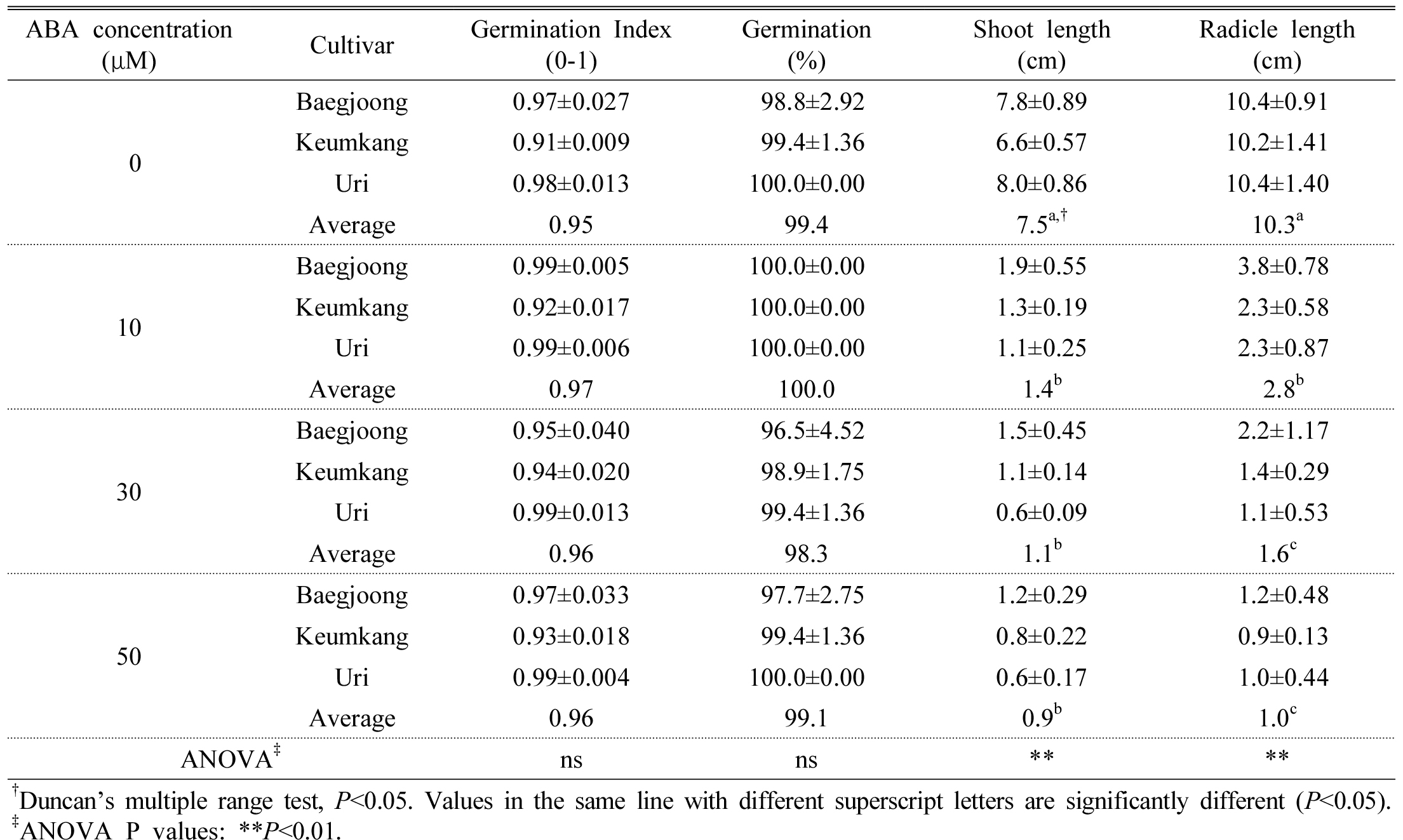
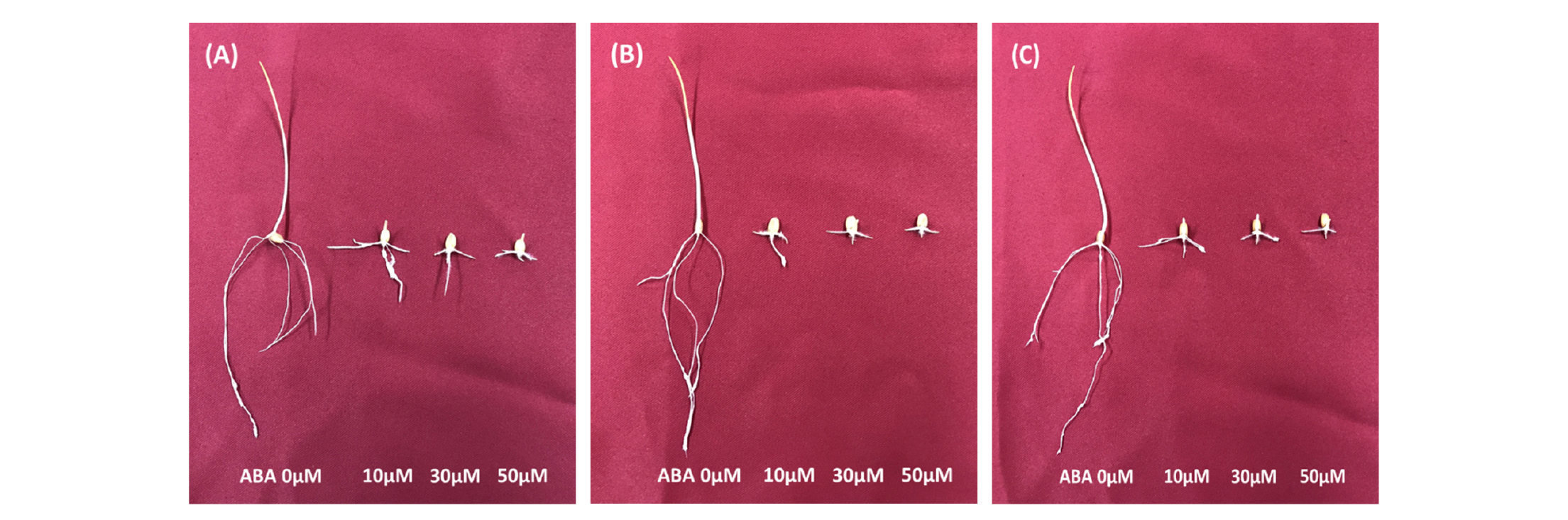
ABA 농도에 따른 백중밀, 금강밀, 우리밀의 발아지수, 발아율, 유아 길이, 유근 길이는 Table 1과 같다. 3품종의 평균 발아지수와 발아율은 0, 10, 30 및 50 μM ABA에서 각각 0.95 이상과 98% 이상이었으며, 발아지수와 발아율 모두 처리 농도 간에 통계적으로 유의한 차이가 없었다. 발아지수와 발아율은 금강밀이 다른 품종보다 다소 낮았다. 하지만 유아와 유근의 생장은 0 μM ABA에 비하여 10, 30 및 50 μM ABA에서 크게 억제되었다(Table 1 & Fig. 1).
Table 1. Germination characteristics of seeds of three Korean wheat cultivars (Baegjoong, Keumkang, and Uri) germinated under different ABA concentrations for 7 d. |
|
ABA는 종자의 발아 억제에 큰 영향을 미치는 것으로 알려져 있다(Kucera et al., 2005; Yu et al., 2016). 밀 배아의 ABA 민감성은 봄 밀 10가지 유전자형에서는 25 μM ABA 이상에서 차이를 보였고(Nyachiro et al., 2002), 가을 밀의 2가지 유전자형에서는 0.5 μM ABA 이상에서 차이를 보였다(Walker-Simmons, 1987). 종자경도가 다른 연질밀과 경질밀의 발아율은 300 μM ABA에서 모두 90% 이상이어서 0 μM ABA에서의 발아율과 큰 차이를 보이지 않다. 유아와 유근의 길이는 발아조사 3일째 이후에는 300 μM ABA 처리구에서 크게 감소되었지만, 7일째 이후에는 300 μM ABA 처리와 0 μM ABA 처리 간에 차이가 크지 않다고 보고된 바 있다(Yu et al., 2016).
벼 종자의 0~50 μM ABA에서의 발아율 및 유근과 유아의 생장을 조사한 결과, ABA 농도가 증가하면서, 발아율은 50 μM ABA에서 20% 수준으로 감소하였고, 유근과 유아의 생장은 10 μM ABA에서 감소하기 시작해서 50 μM ABA에서는 생장이 거의 이루어지지 않았다(Liu et al., 2015). ABA는 커피 배아의 팽창을 억제하여 발아를 포함한 후속 과정을 억제하고, 이후 1 mM ABA를 물로 교체하면 정상적인 발아가 진행된다고 하였다(Da Silva et al., 2008).
ABA는 발아과정뿐만 아니라 발아 이후의 과정에도 깊게 관여하지만, 식물종과 유전자형에 따라 다양한 민감성 범위를 가지는 것으로 알려져 있다.
ABA 처리 배아의 ABA 함량
0 μM ABA와 50 μM ABA 처리구에서 발아한 종자의 배아에 함유되어 있는 ABA 함량은 Table 2와 같다. 배아의 ABA 함량은 0 μM ABA에서는 백중밀, 금강밀 및 우리밀이 각각 0.76, 0.74 및 0.83 ng/mg이었고, 50 μM ABA에서는 백중밀, 금강밀 및 우리밀이 각각 287.41, 222.77 및 296.94 ng/mg으로 처리농도 및 품종 간에 통계적으로 유의한 차이를 보였는데, 금강밀이 다른 품종보다 다소 낮았다.
Table 2. ABA contents in the embryos of three Korean wheat cultivars (Baegjoong, Keumkang, and Uri) germinated under different ABA concentrations for 7 d. |
|
Yu et al. (2016)은 0.01% ABA (378 μM ABA)에서 발아가 억제된 밀 종자와 100 μM H2O2에서 발아가 촉진된 밀 종자의 단백질을 비교한 결과, ABA가 아밀라아제와 헥소키나아제와 같은 가수분해 효소의 활성을 억제한다고 보고하였다. 또한 Gómez-Cadenas et al. (2001)은 ABA와 GA에 대해 종자의 발아가 차이를 보이는데, ABA에 의해 유도된 모종의 단백질이 아밀라아제 발현의 억제를 매개할 수 있다고 하였다. 따라서 배아의 ABA 함량에 따라 탄수화물 가수분해효소의 발현이 조절되어 결과적으로 유아와 유근 생장에 영향을 미친 것으로 생각된다.
ABA 농도에 따른 배아의 단백질체 특성
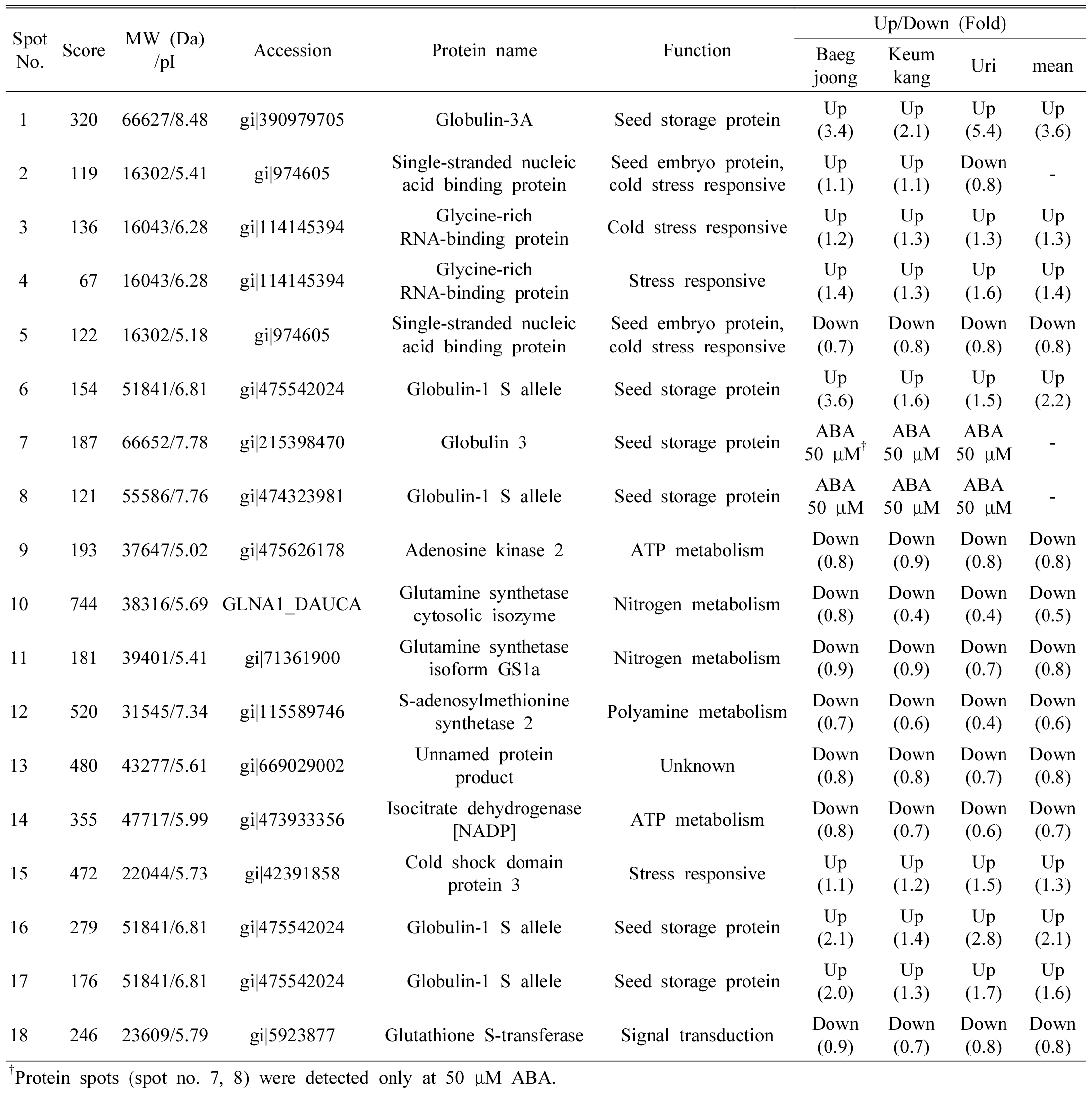
2DGE 젤에서 각각의 등전점 및 분자량에 따라 분리된 단백질체의 각 구성요소는 spot들로 검출되었다(Fig. 2). 3품종의 밀 배아에서 검출된 spot들의 분포 양상은 품종 및 0 μM ABA와 50 μM ABA 처리 간에 명확한 차이를 보였다. 육안 및 ImageMaster software를 이용한 이미지 분석에 의해 발현양상의 변화가 확인된 18개 단백질 spot의 발현양의 변화 양상은 Fig. 3과 같다. 0 μM ABA에 비하여 50 μM ABA에서 발현양이 증가한 단백질 spot (S1, S3, S4, S6, S15, S16, S17)은 7개였으며, 감소한 단백질 spot (S5, S9, S10, S11, S12, S13, S14, S18)은 8개였고, 증가와 감소가 동시에 이루어진 단백질 spot (S2)은 1개였다. 50 μM ABA에서만 확인된 단백질 spot (S7, S8)은 2개였다. 유의미한 발현양의 차이를 보이는 단백질 spot 18점의 이름과 기능을 MALDI TOF/TOF mass spectrometer와 LC/ESI ion Trap mass spectrometer로 동정한 결과는 Table 3과 같다.
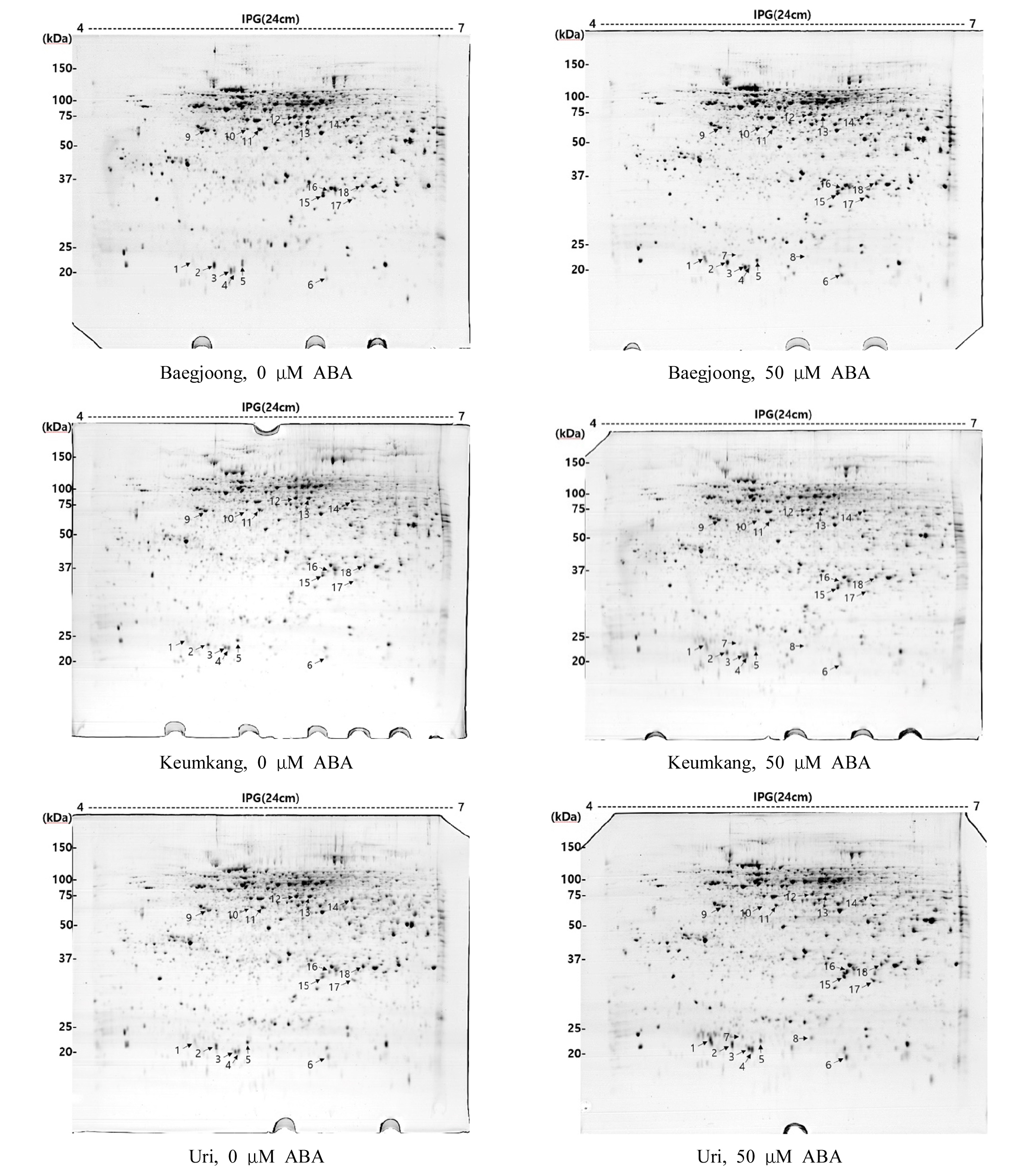
Fig. 2.
Representative 2DGE gels showing protein spots from embryos of three Korean wheat cultivars (Baegjoong, Keumkang, and Uri). Seeds were incubated for 4 d at 20°C in the dark at ABA concentrations of 0 or 50 μM prior to harvesting. Total proteins extracted with LB-TT were separated by 2DGE. An equal amount of total proteins (300 μg) was loaded on each gel. Numbered arrows indicate proteins showing significant quantitative changes at 0 and 50 μM ABA treatments. First dimension (right to left): IEF (pI 4-7) and second dimension (top to bottom): SDS-PAGE (12.5%).
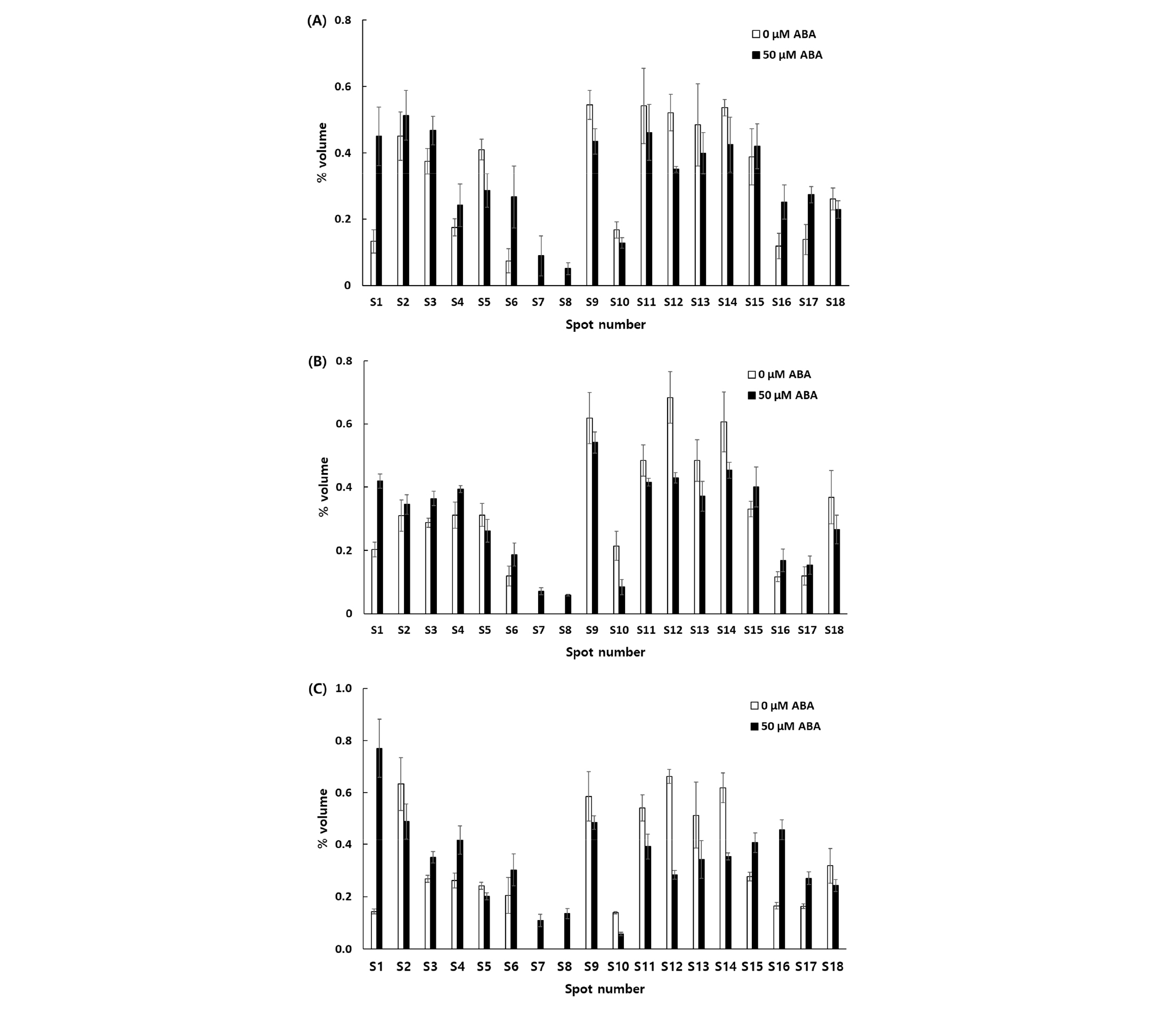
Fig. 3.
Graphical presentations of mean spot volume of 21 selected protein spots from the cultivars Baegjoong (A), Keumkang (B), and Uri (C). Proteins were extracted from seeds germinated for 4 d at 20°C in the dark at ABA concentrations of 0 or 50 μM. The relative spot volume was determined using the ImageMaster 2D Platinum imaging software. Values are means of three replications. Bars indicate standard errors of the mean.
각 단백질 spot은 0 μM ABA 처리구와 비교하여 50 μM ABA 처리구에서 변화된 양을 평균 배수 값(fold 값)으로 표시하였다. 평균 fold 값이 1.5 이상으로 증가한 단백질 spot은 S1 (globulin-3A), S6 (globulin-1 S allele), S16 (golbulin-1 S allele) 및 S17 (globulin-1 S allele)이었고, 이들은 모두 globulin에 속하는 단백질이었다. 또한 ABA 처리구에서만 확인된 단백질 spot인 S7 (globulin 3)과 S8 (globulin-1 S allele)도 globulin 단백질이었다.
밀의 배아에는 globulin(glo)-3-like peptide 등 총 5종의 glo-3계 단백질이 조직 특이적으로 존재한다(Koziol et al., 2012). 또한 Yang et al. (2013)은 중국 밀 품종 SN1391의 배아에서 globulin 3이 발아 직후보다 발아 35시간 후에 2.5배 증가한다고 보고하였다. 한편 밀 배아를 삼투압 스트레스 조건에서 조직배양하면 globulin 1S와 globulin 3A가 증가하여 수분 결핍 조건에서 저항력을 향상시키는 역할을 하는 것으로 보고된 바 있다(Kacem et al., 2016). 수분 결핍 스트레스는 밀에서 ABA 함량의 급격한 상승을 유도하는데, 이 때의 ABA함량은 수분결핍에 대한 저항성 밀이 민감성 밀보다 많다고 하였다(Saeedipour, 2013). 따라서 50 μM ABA에서 globulin류 단백질이 증가한 것은 ABA에 의해 이들 단백질의 발현이 영향을 받았기 때문인 것으로 생각된다.
또한 Vicia sativa 종자에는 globulin이 배아와 자엽에 존재하며, 발아가 시작해서 뿌리가 종피를 뚫고 나올 때는 배아의 globulin을 소모하고, 그 이후에는 시스테인 단백질과 mRNA에 의해 자엽에 있는 globulin의 소모가 유도된다고 하였다(Schlereth et al., 2000). Arabidopsis thaliana에 존재하는 시스테인 단백질 분해효소를 억제하는 AtCYSa는 발아 과정 중에 높은 염농도, 수분 결핍, 산화성 물질, 추위와 같은 다양한 환경적 스트레스에서 발현이 강하게 유도되는 유전자인데, 이 유전자의 프로모터 영역은 탈수-반응 요소와 ABA-반응 요소를 함유하고 있다(Zhang et al., 2008). 따라서 외부의 ABA에 의해서 AtCYSa와 같은 유전자 발현에 의해 스시테인 단백질 분해효소가 억제됨에 따라 globulin이 이용되지 못하고 축적된 것으로 추정된다.
평균 fold 값이 0.7 이하로 감소한 단백질 spot은 S10 (glutamine sysnthetase cytosolic isozyme, GS), S12 (S-adenosylmethionine (SAM) synthetase (SAMS) 2), S14 (isocitrate dehydrogenase NADP, NADP-ICD)이었다. GS는 옥수수에서 질소를 이용하는 연결 고리의 중심 구성요소이며, 아미드 글루타민에서 암모니움 축적을 촉매하는 역할을 한다(Hirel et al., 2005). GS 유전자인 Gln1;2는 애기장대에서 발아하는 종자의 질소 재이동에 매우 중요한 역할을 하며, Gln1;1은 외부에 존재하는 질소에 관여하기 위해 1차 뿌리 발생의 반응에 영향을 미치므로(Guan et al., 2015), glutamine이 발아 초기의 뿌리 발생에 깊게 관여한다는 것을 의미한다. 또한 NADP-ICD는 glutamate 합성에 필요한 2-oxoglutarate를 합성할 수 있다(Gálvez et al., 1999). Glutamate는 발아 이후 유아가 성장하는 동안, 특히 1차 NO3가 없을 때 glutamate dyhydrogenase를 통해 glutamine 합성에 필요한 NH3를 전달한다(Glevarec et al., 2004). 따라서 ABA에 의해 glutamine 합성에 관여하는 다양한 효소의 발현이 하향 조절되어 유아와 유근의 생장을 억제한 것으로 생각된다.
SAMS는 ATP와 L-methionine을 기질로 이용하여 SAM을 생성하는 유일한 효소이다. SAM은 다양한 생물학적 반응에 이용되며 메티오닌 대사의 중심역할을 한다(Martinez-Lopez et al., 2008; Shen et al., 2002). SAM은 보편적인 메틸기 공여체로서 효소에 의해 촉매되는 다수의 반응에 관여한다. 또한 SAM은 에틸렌과 폴리아민의 전구체로 작용하고(Roje, 2006), 폴리아민은 화분 발아와 화분관 신장에 중요하다(Wolukau et al., 2004; Chen et al., 2016). 따라서 50 μM ABA 처리구에서 SAMS의 발현이 감소되어 메틸기 전이활성이 저하되고, 이에 따라 폴리아민 생합성이 감소되어 유아와 유근의 생장이 현저히 억제된 것으로 생각된다.
적요
휴면성이 다른 백중밀, 금강밀, 우리밀 후숙종자의 ABA 농도에 따른 발아 및 배아에서의 단백질체 발현 특성을 조사한 결과는 다음과 같다.
1.백중밀, 금강밀, 우리밀 등 3품종의 0, 10, 30 및 50 μM ABA에서의 평균 발아지수와 발아율은 각각 0.95와 98% 이상으로 통계적으로 유의한 차이가 없었다. 유아와 유근의 생장은 0 μM ABA보다 10, 30 및 50 μM ABA에서 생장이 크게 억제되었는데, ABA 농도가 높을수록 생장이 더 억제되었다.
2.3품종 배아의 평균 ABA 함량은 0 μM ABA와 50 μM ABA에서 각각 0.78 ng/mg과 269.04 ng/mg으로서 농도에 따른 ABA 함량의 차이가 컸다.
3.0 μM ABA 처리구에 비하여 50 μM ABA 처리구에서 발현양이 증가한 단백질 spot (S1, S3, S4, S6, S15, S16, S17)은 7개였으며, 감소한 단백질 spot (S2, S5, S9, S10, S11, S12, S13, S14, S18)은 8개였고, 증가와 감소가 동시에 이루어진 단백질 spot (S2)은 1개였다. 50 μM ABA에서만 검출된 단백질 spot (S7, S8)은 2개였다.
4.각 단백질 spot의 0 μM ABA 처리구 양에 대한 50 μM ABA 처리구 양의 평균 배수 값(fold 값)이 1.5배 이상으로 증가한 단백질 spot은 S1 (globulin-3A), S6 (globulin-1 S allele), S16 (globulin-1 S allele), S17 (globulin-1 S allele) 등으로 모두 globulin류 단백질이었다. 또한 50 μM ABA에서만 확인된 단백질 spot인 S7 (globulin 3)과 S8 (globulin-1 S allele)도 globulin 단백질이었다.
5.각 단백질 spot의 0 μM ABA 처리구 양에 대한 50 μM ABA 처리구 양의 평균 배수 값(fold 값)이 0.7 이하로 감소한 단백질 spot은 S10 (glutamine sysnthetase cytosolic isozyme), S12 (S-adenosylmethionine synthetase 2), S14 (isocitrate dehydrogenase NADP)이었다.
이상의 결과는 ABA에 의한 밀 유묘의 유아와 유근의 생장억제는 배아에서의 ABA 농도 증가, 그리고 이에 따른 배아의 glutamine 합성에 관여하는 다양한 효소의 발현 감소 및 메틸기공여물질의 감소와 이에 따른 메틸기 전이활성의 감소 등이 관여하고 있음을 의미한다. 한편 배아에서의 ABA에 의한 globulin 단백질의 증가는 배아 특이적 globulin의 일시적 합성 증가와 globulin 분해 효소의 활성 억제 등이 복합적으로 관여한 결과로 생각된다.