서론
재료 및 방법
시험 재료 및 저장 조건
조단백질 및 조지방 함량
지방산 조성분석
베타글루칸 함량 분석
아베난쓰라마이드 추출 및 분석
토코페롤, 토코트리에놀 추출 및 분석
항산화 활성 분석
통계 분석
결과 및 고찰
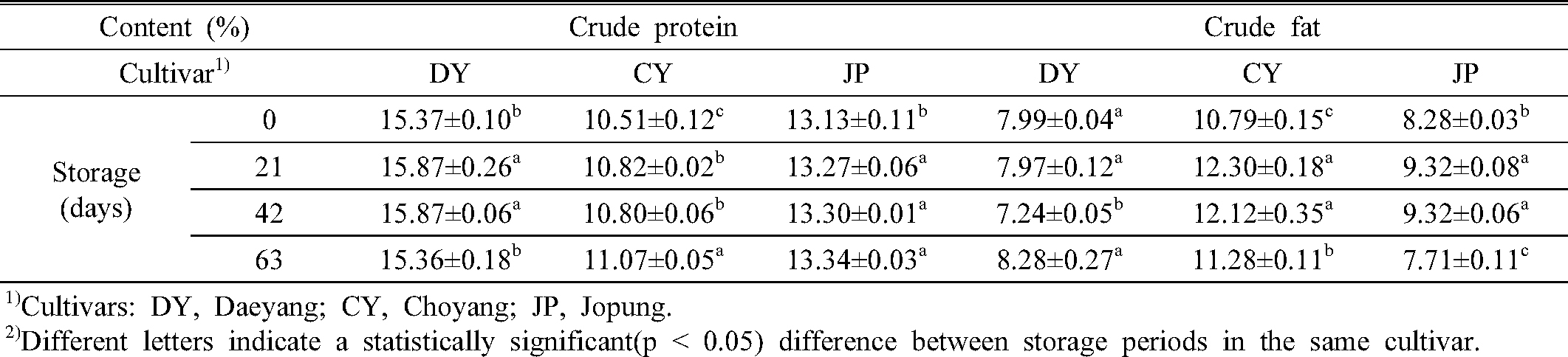
조단백질 및 조지방 함량 분석
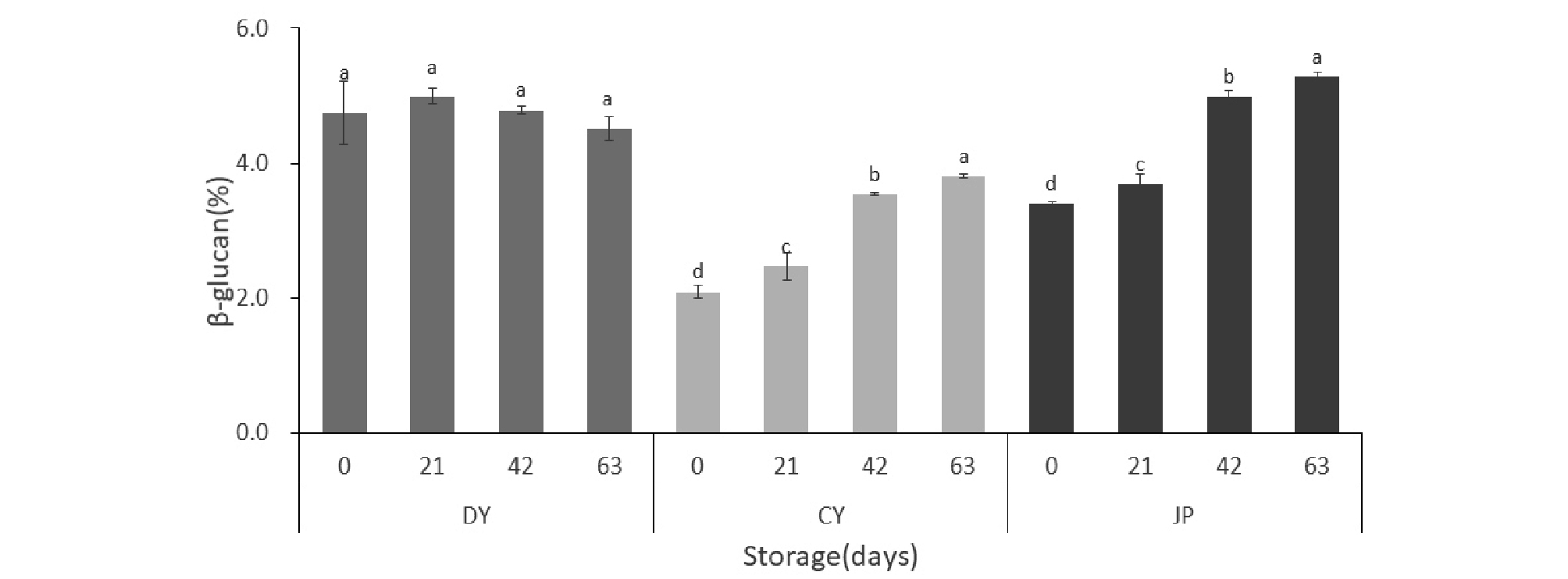
베타글루칸 함량
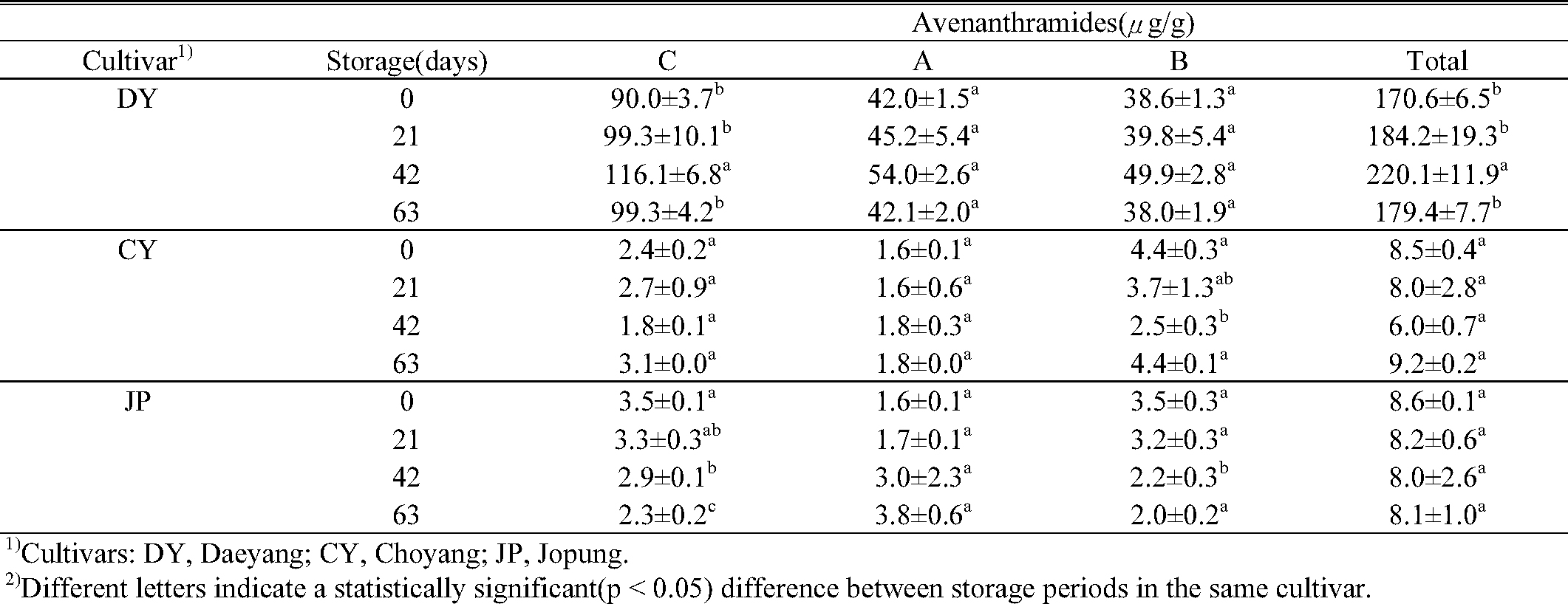
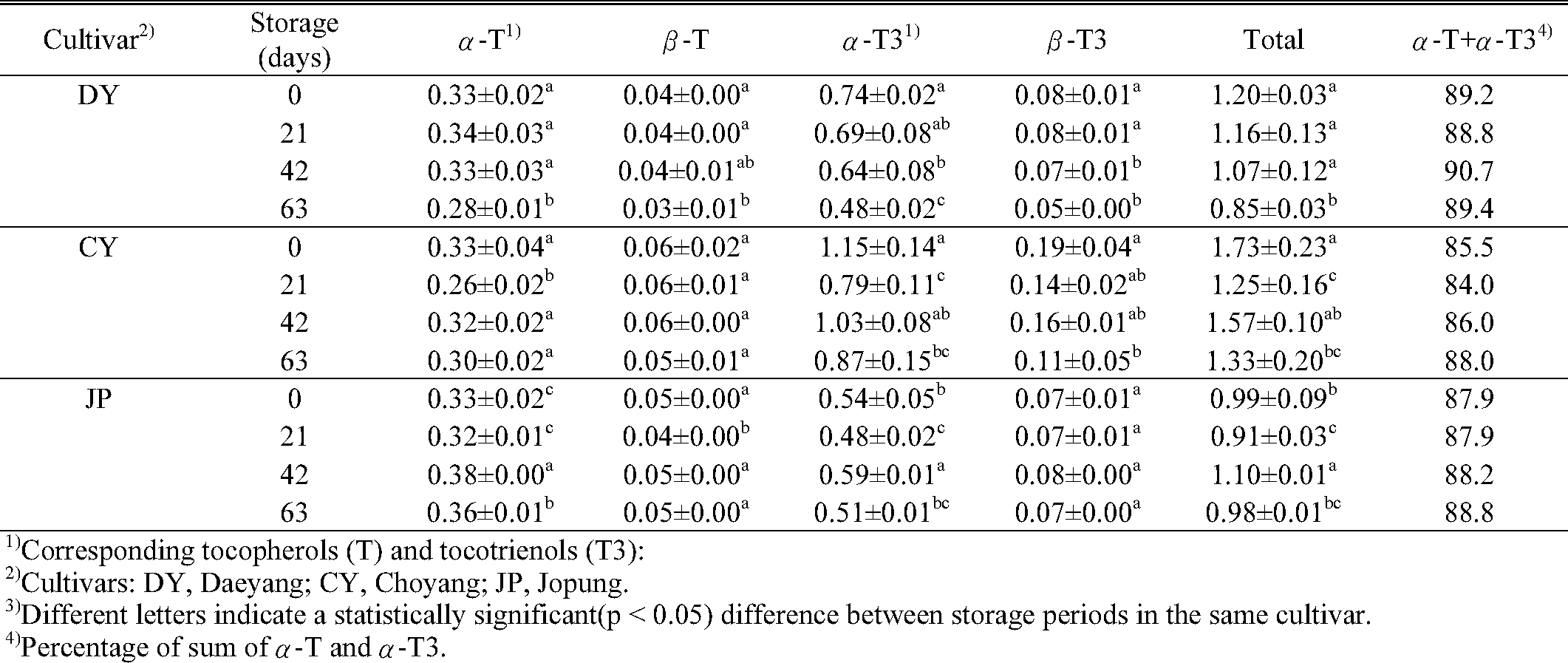
아베난쓰라마이드 및 비타민 E 함량 분석
지방산 조성비
항산화활성 측정
적요
서론
곡물은 저장 중 호흡작용에 의해 각종 효소 활성 및 이화학적특성 변화 등으로 수확 후 품질변이가 발생할 수 있다(Kim et al., 2014; Shin et al., 2017). 곡물의 주요 구성 성분 중 지질은 곡물의 저장 및 가공 과정에서 가장 먼저 변화가 일어난다(Zhoua et al., 1999). 지질은 저장 중 산소와 접촉하여 산화되거나, 가수분해나 곰팡이에 의해 생성된 리파아제로 인해 유리지방산으로 분해되는데, 이와 같은 지질 산화물은 헥사날(hexanal)과 같은 카르보닐 화합물을 형성하여 풍미를 변화시키거나 쓴맛을 내고, 산도를 낮춰 품질을 저하시킨다(Kwak et al., 2015; Zhoua et al., 1999). 또한 저장고내의 온도나 습도가 높으면, 호흡에 의한 양적, 질적 손실이 발생하고 화학적 변화가 일어나며 저곡해충과 미생물 발생이 조장되기 때문에 온·습도의 변화가 높은 저장 조건은 곡물의 품질유지에 악영향을 미친다(Choi et al., 2006; Son et al., 1999). 따라서 수확 한 생산물의 저장 및 관리 기술은 곡물의 질적 손실을 방지하는 중요한 역할을 한다.
귀리(Avena sativa L.)는 벼과 작물로, 탈곡 특성에 따라 겉껍질이 쉽게 제거되는 쌀귀리와 탈곡을 하여도 겉껍질이 종실에 붙어있는 겉귀리로 나뉜다. 다른 곡물에 비해 지질과 단백질의 함량이 높다고 알려져 있으며, 지질 내에서도 불포화지방산의 비율이 79~83%로 높게 차지하고 있다(Jeong et al., 2014; Vilmane et al., 2015; Lee et al., 2016). 또한 귀리는 다양한 기능성 성분을 함유하고 있으며 그 중 2~6%를 차지하고 있는 베타글루칸은 혈중 콜레스테롤을 낮추고 당류 소화흡수를 저해시켜 당뇨병을 예방하는 등 다양한 생리활성을 나타내는 것으로 보고되어 있다(Lee et al., 2016). 비타민 E는 4가지 토코페롤 이성체(α-, β-, γ-, δ-tocopherol)와 4가지 토코트리에놀 이성체(α-, β-, γ-, δ-tocotrienol)로 구성되어 있다. 그 중 알파-토코트리에놀은 대표적 항산화 물질인 알파-토코페롤에 비해 항산화 능력이 40~60배 뛰어나며, 혈중 콜레스테롤 저하, 항염증, 인체 종양세포 억제 기능을 가지고 있다(Aggarwal et al., 2010; Serbinova et al., 1991; Theriault et al., 1999). 귀리는 이러한 알파-토코트리에놀이 많이 함유되어 있으며, 필수아미노산과 미네랄이 풍부하여 기능성 곡물로서 가치가 높다고 알려져 있다(Vilmane et al., 2015; Brindzova et al., 2008). 또한 곡물 중 귀리에 특이적으로 존재한다고 알려진 아베난쓰라마이드(Avenanthramides, AVNs)는 폴리페놀류 화합물로, 다른 페놀 화합물보다 최대 30 배의 높은 항산화 활성을 보이는 것으로 보고되어있다(Emmons & Peterson., 1999). 뿐만 아니라 동맥 혈관에 콜레스테롤 등 혈액 세포가 붙을 때 관여하는 점착성 물질들의 생성을 억제해 혈관이 좁아지는 것을 예방하고, 항염증 및 가려움증 완화에 효과적인 것으로 알려져 최근 새롭게 주목받고 있다(Karlberg, 2010).
일반적으로 가을에 파종한 귀리는 봄에 수확하여 가공되기까지 2-3달이 소요되는 경우가 많아, 수확 후 귀리의 성분이 변하지 않는 안정적인 저장 조건을 찾는 것이 매우 중요하다. 저장 환경을 조절하여 짧은 시간 내에 노화 변화를 유도하여 자연적으로 노화 된 것과 유사한 특성을 가진 곡물을 얻는 과정을 가속 노화라고 하는데(Lee, 2012), 저장 환경 중 온도와 상대 습도는 저장 중 종자 수명에 영향을 미치는 가장 중요한 요소이다. 본 연구에서는 기능성 식품 원료로서 활용을 위해 국내 육성 세 가지 귀리 품종(대양, 조양, 조풍)을 대상으로 온도와 습도를 제어한 노화가속화 조건에서 저장하였을 때, 기능성 성분과 항산화 활성의 변화를 비교하고자 하였다.
재료 및 방법
시험 재료 및 저장 조건
본 연구에서는 쌀귀리 대양, 조양 품종과 겉귀리 조풍을 시료로 사용하였으며, 이 시료는 2016년도 수원에서 추파 재배(2015년 10월 파종, 2016년 6월 수확) 되었다. 귀리는 온도 45℃, 습도(Relative humidity, RH) 20% 로 제어된 노화가속화 조건으로 인큐베이터(DS-14 CLHP, Dasol Scientific, Korea)에서 9주(63일) 동안 저장하였다. 시료는 3주마다 수집하여 동결건조(Lyoph pride LP-10, Ilsinbiobase, Korea) 후 Automill (TK-AM5-B, Tokken Inc, Japan)을 이용해 1,100 rpm으로 200초 동안 분쇄하였다. 분쇄된 시료는 –20℃에 보관하면서 분석에 사용하였다.
조단백질 및 조지방 함량
조단백질 함량은 Micro-Kjeldahl법을 참고하여 측정하였다(NICS, 2009). 분쇄 시료 0.5 g을 단백질 분해관에 넣고 황산 10 mL과 촉매제를 넣어 분해기(Tecator™ Digestor auto, Foss, Denmark)를 이용해 420℃에서 1 시간 동안 분해하였다. 상온에서 충분히 냉각시킨 후 단백질 분석기(Vapodest® 50s, C. Gerhardt GmbH & Co. KG, Germany)를 이용하여 조단백질 함량을 측정하였다.
조지방 함량은 Soxtherm automatic system (Soxtherm® sox416, C. Gerhardt GmbH & Co. KG, Germany)을 이용하여 정량하였다(AOAC, 1990). 분쇄 시료 2 g을 extraction thimble에 담아 탈지면으로 막고 비등석과 n-hexane 140 mL을 첨가하여 187℃에서 30 분간 가열하고, 1 시간 동안 추출하였다. 지방 추출 후 수기를 105℃에서 1 시간 동안 건조 후 방냉 시킨 뒤 무게를 측정하여 함량을 구하였다.
지방산 조성분석
분쇄시료 0.3 g에 methanol : toluene : 2,2-dimethoxypropane : sulfuric acid (39:20:5:2, v/v)로 제조된 지방산 시약 3.3 mL을 가하고 1.7 mL의 heptane을 가하여 65℃에서 20분간 가열하였다. 가열 후 상온에서 10분간 냉각시켜 fatty acid methyl esters (FAMEs)가 함유된 상등액을 magnesium sulfate에 통과시켜 수분을 제거한 뒤 분석하였다. 분석에 사용 된 gas chromatography (GC, HP 6890 system, FID, Agilent, USA) 조건은 초기 온도 150℃, 최종 온도 280℃로 분당 4℃ 증가하도록 설정하였고 injector 온도는 250℃, detector 온도 300℃로 유지하였다. 컬럼은 HP-Innowax capillary (0.25 μm i.d. × 30 m, Agilent, USA)를 사용하였다.
베타글루칸 함량 분석
베타글루칸 함량은 mixed linkage beta glucan kit (Megazyme, Ireland)를 사용하여 분석하였다. 분쇄 시료 0.1 g에 50% ethanol 0.2 mL과 20 mM sodium phosphate buffer (pH 6.5) 4 mL을 넣은 후 100℃ 항온수조에서 3분간 반응 시킨 후 50℃ 항온수조에서 5분 간 냉각시켰다. 0.2 mL Lichenase를 넣고 50℃ 항온수조에서 1 시간 반응시킨 후 냉각시킨 후, 200 mM sodium acetate buffer (pH4.0) 5 mL을 가하였다. 10분간 10,000 rpm으로 원심분리 시킨 뒤 얻은 상등액 0.1 mL에 β-glucosidase 0.1 mL을 넣고 혼합한 뒤, 3 mL glucode oxidase/peroxidase regent를 넣고 다시 50℃ 항온수조에서 20분간 반응시킨 후 냉각시켜 510 nm에서 흡광도를 측정하였다. Standard는 D-glucose (1.0 mg/mL, in 0.2% benzoic acid, w/v)를 사용하였다.
아베난쓰라마이드 추출 및 분석
아베난쓰라마이드는 Chu et al. (2013) 방법을 변형하여 추출하였다. 분쇄 시료 1 g에 0.01 M phosphate buffer (pH 2.8)를 이용해 만든 80% ethanol을 10 mL 넣고 37℃에서 빠르게 교반시켜 17시간 동안 3회 추출하였다. 추출물은 Whatman NO.2 여과지(Whatman International Limited, Kent, UK)를 이용해 여과 한 후 병렬증발농축기(Syncore Analyst, Buchi, Switzerland)로 용매를 완전히 증발시키고 80% ethanol 2 mL 로 재용해하여 분석하였다. Ultra performance liquid chromatography (Acquity UPLC core system, PDA eλ Detector, Waters, USA)를 이용하여 유속 0.6 mL/min으로 분석하였으며, 340 nm에서 결과를 확인하였다. 이동상 A 는 0.01 M phosphate buffer (pH 2.8), B는 acetonitrile을 사용하여 B 용매 15%에서 80% 까지 기울기를 주었고, 컬럼은 Acquity UPLC® HSS C18 (2.1x100 mm, 1.8 ㎛, Waters)을 사용하였다.
토코페롤, 토코트리에놀 추출 및 분석
토코페롤과 토코트리에놀의 추출은 Lee et al., (2012)를 참고하였다. 분쇄 시료 2 g에 6% propyl gallate가 포함된 ethanol 용액 10 mL을 넣고 5분 동안 sonication 시킨 후 60% potassium hydroxide 10 mL을 넣고 70℃ 항온수조에서 50분 동안 반응시켰다. 얼음에서 냉각시킨 뒤 2% sodium chloride 30 mL을 넣고 잘 섞어준 다음 0.01% butylated hydroxytoluene이 포함 된 혼합용액(Hexane:Ethyl acetate=85:15, v/v) 20 mL 넣고 흔들어 준 뒤 상등액을 magnesium sulfate에 여과시켜 주는 과정을 3회 반복하여 추출하였다. 추출물은 50 mL 용량플라스크에 정용한 뒤 5 mL을 질소가스로 농축하여 HPLC 이동상 1 mL로 재용해하여 분석하였다. HPLC (515pump, 2475 Fluorescence Detector, 717 Autosampler, Waters)는 등용매 조건으로 유속 1.5 mL/min으로 분석하였으며, 형광 검출기의 excitation wavelength는 290 nm, emission wavelength는 330 nm로 설정하였다. 이동상은 n-hexane : Isopropanol (99:1, v/v), 컬럼은 Lichrospher® 100 Diol (4.6 X 250 mm, 5 ㎛, Hibar, Merck, Germany)을 사용하였다.
항산화 활성 분석
항산화 활성 측정을 위한 methanol 추출물은 분쇄 시료 5 g에 80 mL의 methanol을 가한 뒤, 25℃에서 16시간 교반하여 추출하였다. 추출물은 Whatman NO.2 여과지(Whatman International Limited, Kent, UK)에 여과 한 뒤, 병렬증발농축기(Syncore Analyst, Buchi, Switzerland)로 증발시켜 추출 수율을 측정하고 다시 methanol로 재용해하여 사용하였다. 추출물은 질소 충진 후 –20℃에 보관하였다.
1,1-diphenyl-2-picrylhydrazyl (DPPH) 라디칼 제거능은 희석한 메탄올 추출물 50 μL에 0.2 mM DPPH 용액 1 mL를 가한 뒤, 상온에서 30분간 반응시켜 520 nm에서 흡광도를 측정하였다. 2,2′-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid (ABTS) 라디칼 제거능은 7.4 mM ABTS와 2.6 mM potassium persulfate를 암소에 보관하여 ABTS 라디칼을 형성시킨 뒤 734 nm에서 흡광도 값이 1.0 이 되도록 증류수로 희석한 용액을 사용하였다. 메탄올 추출물 30 μL에 희석된 ABTS 용액 1 mL를 가한 뒤, 상온에서 60분간 반응시켜 734 nm에서 흡광도를 측정하였다. 표준곡선은 0~300 ppm의 농도로 Trolox를 이용하여 작성하였고, 실험 결과는 Trolox equivalent antioxidant capacity (TEAC)로 환산하여 mg/100 g 으로 표현하였다.
통계 분석
실험 결과는 평균±표준오차로 표시하였다. 통계분석은 SPSS 프로그램(Version 18.0, SPSS Inc., Chicago, IL, USA)을 이용하였고, 처리 평균간 비교를 위해 분산분석(ANOVA)을 수행하였다. 유의성이 있을 경우 5% 유의수준에서 Duncan의 다중검정을 실시하였다.
결과 및 고찰
조단백질 및 조지방 함량 분석
귀리는 라이신 함량이 높고 프롤라민 함량이 낮아 다른 곡물에 비해 단백질의 품질이 좋은 것으로 알려져 있으며, 높은 불포화지방산 비율로 인해 좋은 에너지 공급원이 된다(Kaur et al., 2016). 노화가속화 조건에서 국내 육성 귀리 세 품종의 함량의 변화를 분석한 결과, 단백질 함량은 대양 15.36 ~ 15.87%, 조풍 13.13 ~ 13.34% 조양 10.51 ~ 11.07% 순으로 나타났고, 조지방은 조양 10.79 ~ 12.30%, 조풍 7.71 ~ 9.32%, 대양 7.24 ~ 8.28%의 함량을 가지고 있는 것으로 나타났다(Table 1). 대양은 단백질 함량이 높고 지방 함량이 낮은 반면, 조양은 지방 함량이 높고 단백질 함량이 낮은 것으로 나타나 귀리 품종 간에 차이를 보였다. 그러나 본 연구에서 설정한 노화가속화 조건에서 저장 기간 동안 단백질과 지방 함량의 유의적인 차이는 나타나지 않았다. 벼 종실의 장기 저장에 관한 Lee et al., (1993)의 연구에 따르면 곡물의 단백질 함량과 지방산가는 저장 4개월 후부터 급격하게 변화한다고 보고하고 있기 때문에, 9주 동안의 저장기간은 귀리의 단백질과 지방함량에 큰 영향을 주지 않는 것으로 생각된다.
베타글루칸 함량
귀리의 베타글루칸 함량을 분석 한 결과, 대양은 큰 변화 없이 저장기간 동안 함량을 유지하였지만, 조양(2.09%에서 3.81%)과 조풍(3.39%에서 5.27%)은 저장기간이 길어질수록 약간 증가하는 경향을 보였다(Fig. 1). Lorraine L. Niba(2003)의 연구 결과에 의하면 베타글루칸은 다양한 요인에 의해 영향을 받기 때문에, 저장 시 발생하는 곡물의 물리·화학적 변화는 베타글루칸의 가용성 및 용해도를 증가시킬 수 있어 베타글루칸의 함량이 증가한다는 연구결과를 보고한바 있다. 또한 보리는 고온 조건에서 베타글루칸이 분해되기 때문에 볶음처리와 같은 건조 열처리는 용해되는 베타글루칸의 양을 늘려 전체 함량을 증가시킬 수 있다고 한다(Zhang et al., 1998; Wallwork et al., 1998). 따라서 베타글루칸은 귀리 품종의 고유 특성과 온도 등 환경요인에 의해 영향을 받는 성분으로 저장 조건에 따라 변화할 수 있을 것으로 생각된다.
아베난쓰라마이드 및 비타민 E 함량 분석
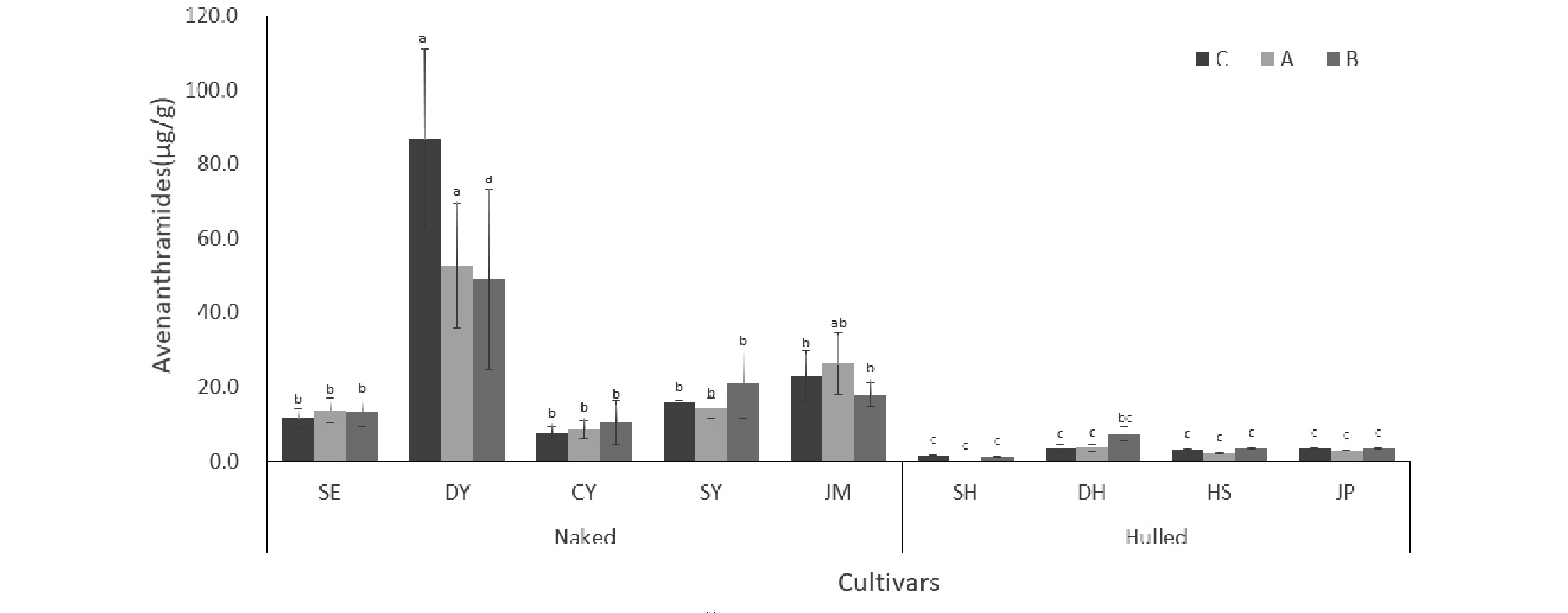
아베난쓰라마이드류는 약 20여 가지가 알려져 있지만 그 중 A, B, C가 가장 대표적인 성분이다(Meydani, M., 2009; Bratt et al., 2003). 국내에서 육성된 쌀귀리 5 품종(선양, 대양, 조양, 수양 및 중모 2005)과 겉귀리 4 품종(삼한, 동한, 하이스피드 및 조풍)의 아베난쓰라마이드 함량을 분석 한 결과 겉귀리보다 쌀귀리에서 아베난쓰라마이드를 다량 함유하고 있는 것으로 나타났다(Fig. S1). 본 연구에서는 탈곡 특성이 다르고, 아베난쓰라마이드 함량이 차이가 났던 쌀귀리 2 품종(대양, 조양)과 겉귀리 1 품종(조풍)을 대상으로 노화 가속화 조건에서 저장기간에 따른 아베난쓰라마이드 함량을 분석하였을 때, 대양을 제외한 총 아베난쓰라마이드 함량은 통계적 유의성이 나타나지 않았다. 따라서 귀리의 아베난쓰라마이드는 노화가속화 조건에서 큰 변화 없이 유지되어 저장 기간에도 항산화 활성을 유지하는데 기여 하는 것으로 예상된다. 귀리 품종의 아베난쓰라마이드 함량은 대양(170.6 μg/g)이 조양(8.5 μg/g)과 조풍(8.6 μg/g)에 비해 총 아베난쓰라마이드가 매우 많은 것으로 나타났다. 특히 아베난쓰라마이드 C는 아베난쓰라마이드 중에서도 가장 높은 항산화활성을 보이는 것으로 알려져 있는데(Emmons & Peterson, 1999; Meydani, M., 2009), 대양은 아베난쓰라마이드 C의 함량이 A와 B에 비해 높았으며, 조양과 조풍은 Fig. S1과 비슷한 수준으로 나타났다. 아베난쓰라마이드는 생육 중 이삭의 등숙기에 따라 합성과 출현에 영향을 받는 것으로 알려져 있다(Peterson & Dimberg, 2008). 위 연구에 따르면 아베난쓰라마이드는 출수 직후 A와 B가 먼저 활성이 되고, C는 출수 후 21~22일이 지난 뒤 활성이 나타나 수확 전까지 농도가 증가하는 것으로 보고되었다. 노화가속화 조건에서 대양 품종은 아베난쓰라마이드 C의 함량이 가장 많았으며, C는 이삭의 등숙 정도에 영향을 많이 받는 것으로 보아, 저장기간 동안에 총 아베난쓰라마이드 함량에 유의성을 나타낸 것은(Table. 2) 본 연구에 사용된 귀리의 등숙률이 일정하지 않아 같은 시료에서 약간의 변이가 나타나는 것으로 추측된다.
비타민 E는 토코페롤과 토코트리에놀에 의해 활성화되는데, 세포막에서 지질의 과산화 작용을 억제하여 항산화 활성을 나타낸다고 알려져 있다(Qureshi et al., 2000). 귀리 세 품종의 토코페롤과 토코트리에놀을 분석 한 결과, 알파-토코페롤, 베타-토코페롤, 알파-토코트리에놀, 베타-토코트리에놀 등이 주로 함유 된 것으로 나타났다. 이 중 알파-토코페롤과 알파-토코트리에놀은 지질이 정제될 때 변하지 않는 가장 안정적인 항산화 성분이라고 알려져 있는데(Sterna et al., 2016), 모든 품종(대양: 88.8 ~ 89.7%, 조양: 84.0 ~ 88.0%, 조풍: 87.9 ~ 88.8%)에서 알파-토코페롤과 알파-토코트리에놀의 비율이 높았다. 저장기간 중 총 비타민 E 함량은 대양이 1.20 mg/100 g에서 0.85 mg/100 g, 조양이 1.73 mg/100 g에서 1.33 mg/100 g으로 감소하였으며, 겉귀리인 조풍은 비타민 E 함량이 쌀귀리 품종보다 낮지만 저장 후의 변화가 적은 것으로 나타났다(Table 3). 항산화제로서 토코페롤과 토코트리에놀은 지질 과산화 반응을 일으키는 lipid peroxy radical에 수소를 전달하여 제거하는 역할을 하는데, 이 과정에서 산화되어 함량이 감소하는 것으로 알려져 있다(J. Falk et al., 2010; M.E. Player et al., 2006). 따라서 저장 과정에서 대양과 조양에서 나타나는 비타민 E 함량의 감소는 항산화제로 작용하여 항산화 활성유지를 위해 산화된 것으로 생각된다.
Table 3. Tocopherol and tocotrienol (mg/100g) contents according to oat cultivars and storage duration. |
|
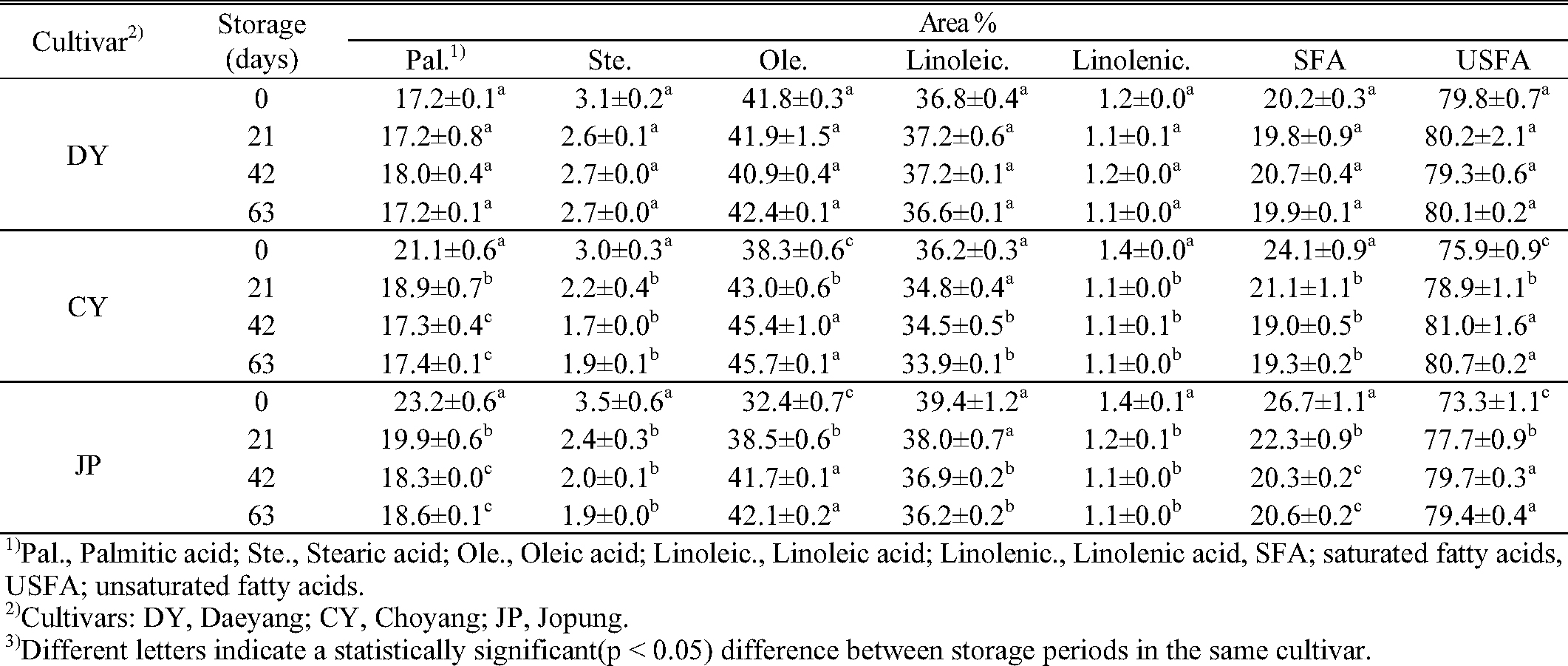
지방산 조성비
식이지방의 종류에 따라 혈중 지질에 미치는 영향이 다른데, 불포화 지방산(unsaturated fatty acids, USFA)은 혈중 총 콜레스테롤 수준을 저하시키고, HDL 콜레스테롤 함량을 증가시켜 심혈관계 질환 발생의 위험을 낮추는 역할을 한다고 알려져 있다(Jung & Paik, 1993). 식물체에 주로 존재하는 지방산의 형태는 palmitic acid(C16:0), stearic acid (C18:0) 등 포화지방산 2 종류와, oleic acid (C18:1), linoleic acid (C18:2), linolenic acid (C18:3) 등 불포화지방산 3 종류가 주류를 이루고 있는 것으로 알려져 있어(Cho et al., 2011), 5가지 지방산의 저장기간 동안 조성비의 변화를 분석하였다. 귀리 원곡 시료에서 불포화지방산의 비율은 대양(79.8%), 조양(75.9%), 조풍(73.3%) 순으로 높았으며, 그 중에서도 oleic acid(대양: 41.8%, 조양: 38.3%, 조풍: 32.4%)와 linoleic acid(대양: 36.8%, 조양: 36.2%, 조풍: 39.4%)가 대부분을 차지하고 있었다(Table 4). 조양과 조풍에서는 저장기간이 길어질수록 불포화 지방산의 비율이 증가(조양: 75.9%에서 80.7%, 조풍: 73.3%에서 79.4%)하였고, 포화지방산의 비율은 감소하였다. 불포화지방산 중에서도 oleic acid의 비율이 유의적으로 증가하였으며, linoleic acid와 linolenic acid의 비율은 감소하였다. 반면, 대양은 저장기간 동안 일정하게 유지되는 것을 확인 할 수 있었다. 이 결과는 Jung 등(2012)의 연구에서 등숙 중 콩은 고온 처리에 의해 oleic acid가 증가하고 linoleic acid와 linolenic acid가 감소되는 경향을 보이는 것과 일치하였지만, palmitic acid와 stearic acid의 조성이 온도 변화에 증가되는 경향을 보인다는 결과와는 다르게 고온에서 두 성분의 조성 비율이 감소되는 경향을 보였다. 또한 Kim 등(2014)의 벼 정조 저장에 관한 연구 결과에 따르면, 품종 간의 차이로 저장 중 지방산 조성 변화를 확인하기 어렵지만, 저장 기간이 길어질수록 품종에 따라 다른 경향이 나타난다고 보고하였다.
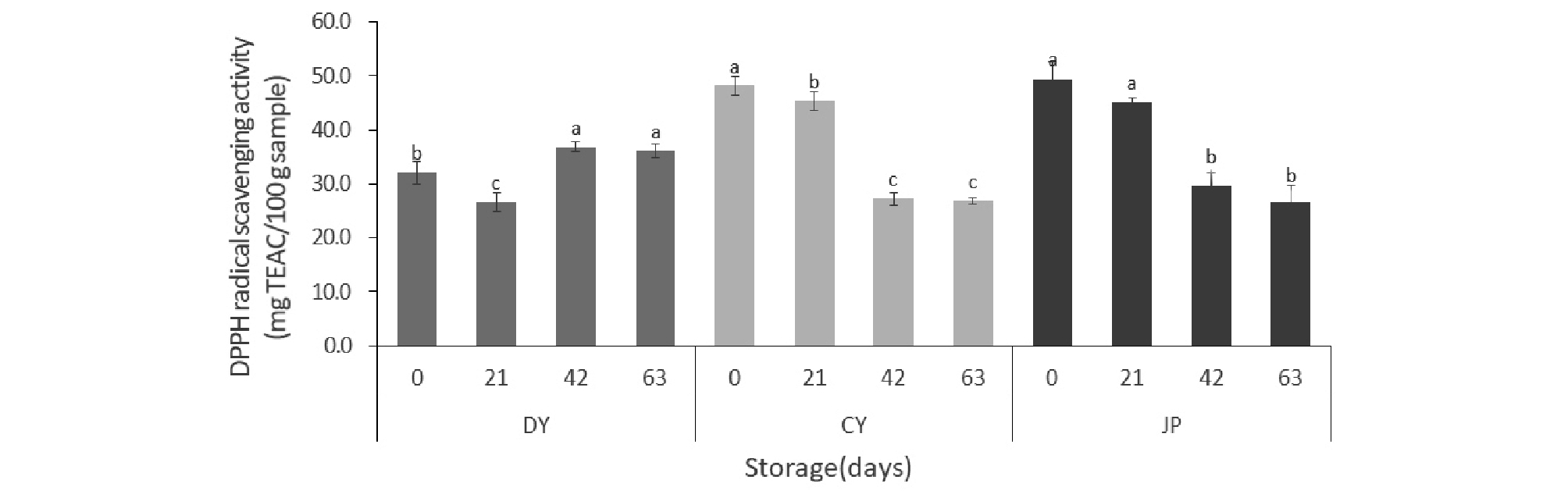
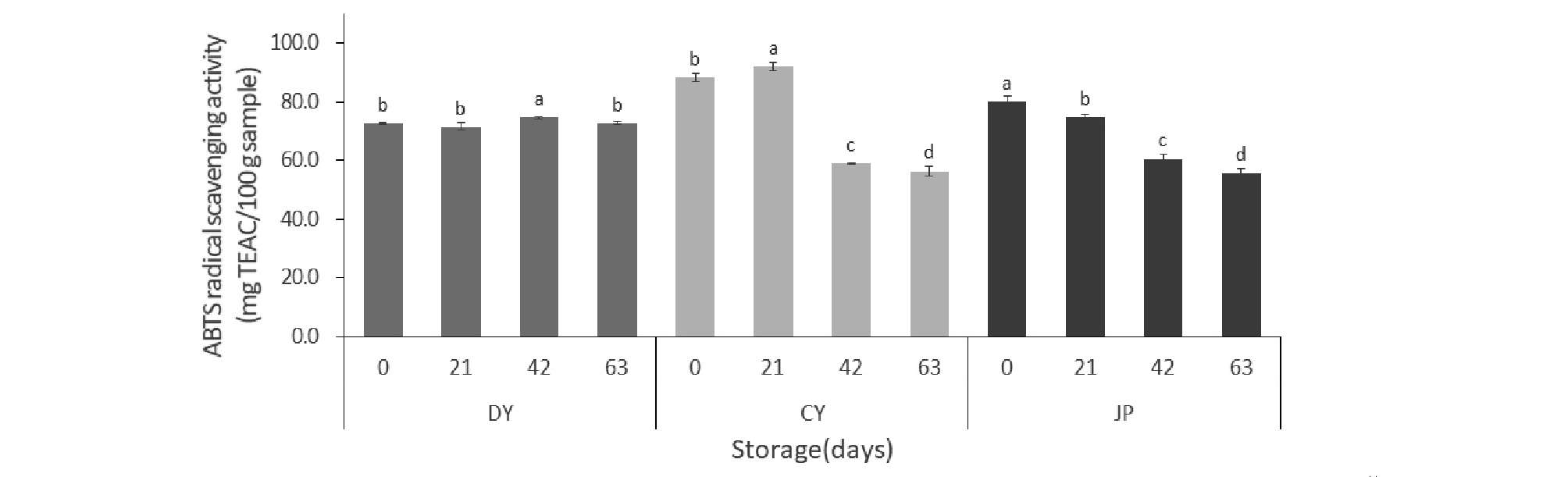
항산화활성 측정
활성산소인 자유 라디칼(free radical)은 인체 내에서 각종 질병을 유발하고 세포의 노화 유도하기 때문에 귀리에서 항산화제로 작용하는 물질의 활성에 대해 확인하고자 저장기간 동안 DPPH, ABTS 활성 변화를 확인하였다. DPPH 라디칼 제거능은 항산화 물질의 전자공여능을 측정할 때 사용하는 방법으로, 전자공여능은 지질과산화 반응에 관여하는 자유 라디칼에 전자를 공여하여 산화를 억제시키는 척도가 된다(Lee et al., 2017). 저장기간 동안 항산화 활성의 변화를 살펴보면, DPPH 라디컬 제거능의 경우 대양(32.1 mg TEAC/100 g에서 36.0 mg TEAC/100 g)은 비교적 안정적인 변화를 보인 반면에, 조양과 조풍은 42일 이후에 크게 감소하는 형태를 나타냈다(CY; 48.1 mg TEAC/100 g 에서 26.9 mg TEAC/100 g, JP; 49.4 mg TEAC/100 g 에서 26.7 mg TEAC/100 g)(Fig. 2). ABTS 라디컬 제거능 역시 DPPH 라디컬 제거능과 같은 경향을 보였다(DY; 72.6 mg TEAC/100 g 에서 72.7 mg TEAC/100 g, CY; 88.4 mg TEAC/100 g 에서 56.3 mg TEAC/100 g, JP; 80.0 mg TEAC/100 g 에서 55.8 mg TEAC/100 g)(Fig. 3). Ham 등(2015)의 연구에서 국내 육성 귀리 품종 중에서 대양이 가장 높은 항산화 활성을 나타내고 항산화 활성에 기여하는 항산화 성분은 비타민 E가 아닌 폴리페놀류 화합물인 것으로 보고하였다. 본 연구 결과, 세 품종 중에서 페놀류 항산화 물질인 아베난쓰라마이드가 높은 대양이 다른 품종에 비해 노화가속화 조건에서 비교적 항산화활성이 잘 유지되는 것으로 생각되며 이는 기존의 연구결과와 일치하였다.
적요
국내 육성 귀리인 대양, 조양, 조풍을 노화가속화 조건(45℃, RH < 20%)에서 63일간 저장하였을 때, 귀리의 기능성 성분과 항산화 활성 변화는 아래와 같다.
1.단백질, 지방 함량은 세 품종 모두 저장 기간 동안 큰 변화 없이 유지되었다.
2.항산화성분 중 아베난쓰라마이드는 저장 기간 동안 함량이 유지되었지만, 비타민 E는 63일의 저장 기간 동안 대양과 조양 품종에서 함량이 감소하는 경향을 보였다.
3.조양과 조풍은 저장 후 베타글루칸 함량과 불포화지방산 함량이 점점 증가하였지만, 대양은 원곡의 함량을 유지하였다.
4.항산화 활성 측정 결과, 대양은 저장기간 동안 큰 폭의 변화 없이 함량을 유지한 반면, 조양과 조풍은 42일 이후 감소하는 양상을 보였다.