서론
재료 및 방법
재배방법 및 시험재료
식미 관능평가
아밀로스 함량 및 아밀로펙틴 측쇄사슬 길이 분포
단백질 함량 및 저장 단백질 조성
통계분석
결과 및 고찰
재배지역의 기상현황
쌀 완전미율 및 식미 관능평가 차이
전분구조 특성 차이
저장단백질 특성 차이
적요
서론
조생종 벼를 평야지에 조기 재배하는 이유는 햅쌀이 묵은 쌀에 비해 소비자의 선호도가 높고, 특히 추석을 앞두고 조기 재배된 햅쌀은 기존의 중생종, 중만생종 쌀의 출하 전 판매를 통한 틈새시장으로서의 장점이 있기 때문이다. 또한 평야지 대부분에서 중생종 또는 중만생종 품종이 재배됨에 따라 벼 수확 및 건조가 10월에 집중되어 적기 수확 및 건조가 어렵고, 이는 쌀 품질 저하의 원인이 되고 있다. Lee et al. (2008) 등은 이러한 문제의 해결책으로 평야지 조기재배를 통한 벼 수확시기의 분산을 제시한 바 있다. 반면, 평야지 재배나 조기 재배에 따른 조생종 품종의 쌀 품질 저하의 주요 원인은 고온등숙 때문이며 고온등숙으로 인해 분상질립과 단백질 함량의 증가로 외관 품질과 식미가 크게 떨어진다고 하였다(Choi et al., 1994; Choung et al., 2004; Lee et al., 2008; Lee et al., 2012).
국내에서는 고온등숙에 따른 쌀 품질 저하와 관련하여 전분의 구조적 특성, 저장단백질 특성 등에 대한 연구가 상대적으로 미흡한 실정이나, 전 세계적으로는 기후온난화 관련 고온등숙 연구가 활발히 진행되고 있다. 관련 연구로는 기후온난화 대응 벼의 고온등숙 조건에 따른 아밀로펙틴 사슬길이의 차이, 전분합성 유전자의 발현 차이 등 전분구조 특성 관련 보고(Chun et al., 2015; Jiang et al., 2003; Pandey et al., 2012; Yamakawa et al., 2007; Zhang et al., 2016)와 고온등숙 조건에서 벼의 종자 저장단백질의 하나인 프롤라민 합성이 저해된다는 보고 등이 있다(Lin et al., 2010; Yamakawa et al., 2007). 이와 같이 전 세계적 관심분야인 기후온난화와 국내 조생종 벼의 평야지 재배에 대한 공통적인 문제점은 고온등숙이라고 할 수 있으며, 고온등숙 관련 연구의 중요성 및 필요성을 알 수 있다.
국내 밥쌀용 쌀은 전분 함량이 약 90%, 단백질 함량이 약 5-7% 등으로 전분과 단백질이 대부분을 차지하고 있다. 쌀 전분은 아밀로스와 아밀로펙틴으로 구성되어 있으며, 아밀로스 함량이 낮고 아밀로펙틴의 단쇄 사슬길이(A-chain)의 비율이 높을수록 밥의 찰기가 높고 경도가 낮아, 쌀을 구성하는 성분들의 절대 함량 뿐 아니라 구조적 특성 또한 식미와 밀접한 관계가 있는 것으로 보고되어 있다(Kang et al., 1995; Yoon et al., 2012). 뿐만 아니라 알부민, 글로부린, 글루텔린 및 프롤라민으로 구성되어 있는 쌀 단백질 또한 그 구성 비율이 식미, 영양성, 가공적성 등에 영향을 주는 것으로 알려져 있다(Furukawa et al., 2006; Kwak et al., 2016; Matsue et al., 1995). 따라서 본 연구는 조생종 벼의 평야지 재배에 따른 등숙기 고온 환경으로 인한 전분구조와 종자 저장단백질 특성 차이를 평가하여 쌀 품질향상을 위한 기초자료로 제공하기 위해 수행 되였다.
재료 및 방법
재배방법 및 시험재료
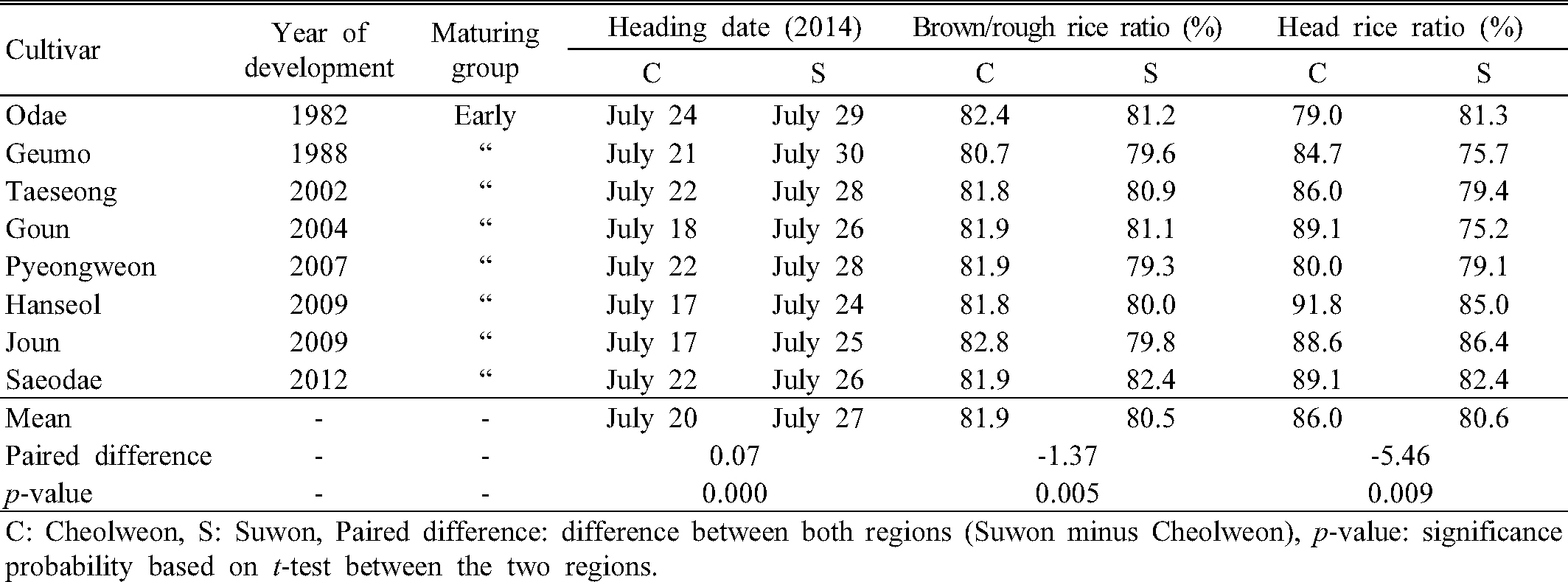
시험재료는 철원 및 수원 지역에서 2014년에 재배되었고, 시험지의 지리적 특성 및 기상조건은 Table 1과 같다. 철원과 수원 지역에서의 파종은 각 4월 20일과 4월 25일에 시행하였고, 두 지역 모두 30일 묘를 이앙하였다. 그 외 지역별 벼 재배방법 및 외관품질 조사는 농촌진흥청 표준재배법에 따라 수행되었다(RDA, 2012). 공시재료 8 품종은 오대 등 조생종 벼 품종으로, 1982년부터 2012년까지 지난 30년 동안 개발된 대표적인 품종을 선발하여 공시하였다(Table 2).
식미 관능평가
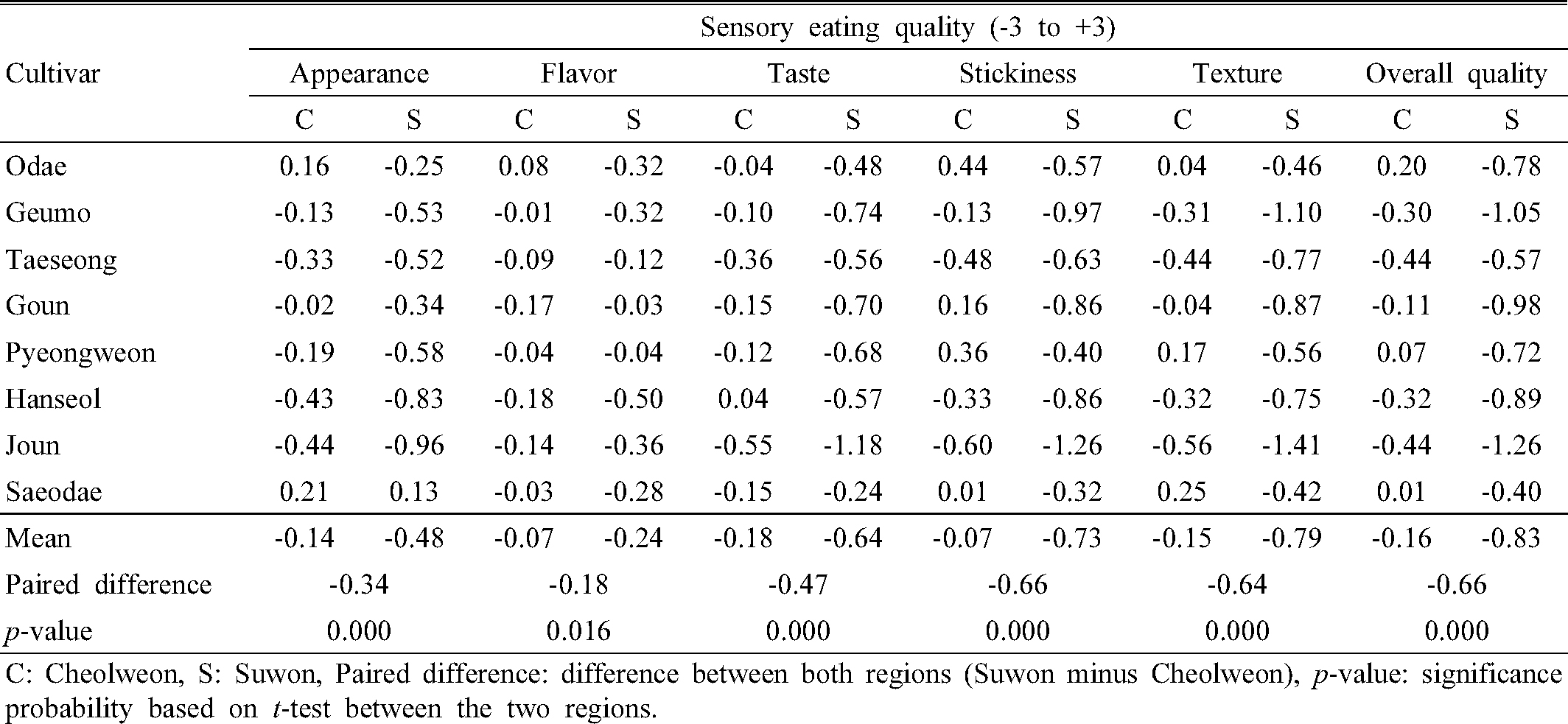
식미 관능평가는 추청벼를 대비 시료로 하여 상대 비교 방법인 7점 척도(+3 ~ -3)법으로 수행하였다. 식미 관능평가 패널은 국립식량과학원 벼 연구 분야에서 장기간 관능평가를 수행한 잘 훈련된 15~20명이 참여 하여 밥의 모양, 냄새, 맛, 찰기, 질감 등 5가지 항목에 대하여 개별평가를 한 후 종합적인 총평을 평가하도록 하였다(NICS RDA 2003).
아밀로스 함량 및 아밀로펙틴 측쇄사슬 길이 분포
아밀로스 함량은 비색정량법에 따라 시료 100 mg에 95% 에탄올과 1 N sodium hydroxide를 가한 후 호화시킨 전분 호화액에 1 N acetic acid와 0.2% I2-KI 용액을 첨가하여 요오드 정색반응 후 620 nm 파장에서 흡광도를 측정하였다(NICS RDA 2003). 아밀로펙틴 측쇄 사슬길이의 분포는 HPAEC-PAD (high performance anion exchange chromatography-pulsed amperometric detection)를 이용하여 분석 하였으며(Hanashiro et al., 1996), 시료를 90% methanol 처리 후 중탕 가열한 호화액에 sodium azide 용액, 600 mM sodium acetate buffer (pH 4.4), isoamylase를 첨가하여 교반 후 37℃에서 24시간 반응 시켰다. 반응액은 0.2 ㎛ syringe filter로 여과 후 100 μL를 주입하였으며 분석 컬럼은 CarboPac TM PA-1 column (2.0×250 mm, Dionex, USA), 이동상 용매는 150 mM sodium hydroxide와 500 mM sodium acetate를 분당 1.0 mL의 유속으로 흘려 분리하였고 기체는 질소를 사용하였다.
단백질 함량 및 저장 단백질 조성
시료의 조단백질은 AOAC법(1995)에 준하여 Micro Kjeldahl법을 이용하여 자동분석(Foss Digester 2020, Foss Kjeltec 2400, Foss Tecator, Huddinge, Sweden)하였다. 쌀 저장단백질 분석을 위한 시료는 ball mill (Pulverisette23, FRITSCH GmbH, Germany)을 이용하여 분쇄하였으며 분쇄한 시료 0.1 g에 lysis buffer (6 M Urea, 50 mM Tris-HCl, pH 6.8, 2 mM DTT, 10% glycerol) 1 mL를 첨가하여 쌀 단백질을 추출하였고, 얻어진 추출물은 13,000 rpm에서 10분간 원심분리 한 후 상층 액을 얻어 단백질 전기영동을 실시하였다. 단백질 전기영동은 Agilent 2100 Bioanalyzer system (Agilent, Santa Clara, USA)과 Protein 80 Lab Chip kit를 이용하였다. 분석용 샘플의 전처리는 kit에 제공된 분석 방법(Bousse et al. 2001)에 따랐다. 저장단백질 조성 분석은 Kwak et al. (2016)의 방법에 따라 전기영동 결과 얻어진 전체 크로마토그램 피크에서 알부민, 글로부린, 글루텔린, 프롤라민에 해당하는 각 크로마토그램이 차지하는 상대적 비율을 구하였다.
통계분석
통계분석은 SPSS (v13.0)을 이용하여 지역 간 동일 품종에 대해 쌍을 이룬(paired-samples) t-test를 실시하였고 유의성 수준은 p-value로 표시하였다.
결과 및 고찰
재배지역의 기상현황
시험지역인 철원은 북위 38°15‘, 해발고도가 192 m인 중북부 산간지역이고, 수원은 북위 37°16’, 해발고도가 37 m인 중부 평야지역이다. 이 두 지역의 출수 후 40일 동안의 온도, 일조시간 및 강수량은 Table 1과 같다. 출수 후 40일 동안의 기상자료를 이용한 이유는 우리나라에서 자포니카 벼에 알맞은 등숙기간(출수 후 40일)의 일평균기온이 21.5℃로 알려져 있고, 수량적 측면에서의 적정 등숙온도는 21~23℃라고 보고된 것에 근거하였다(Yun & Lee, 2001). 출수 후 40일 동안 철원은 수원에 비해 평균기온, 최저 및 최고기온이 모두 낮았고, 일평균기온은 철원 24.5℃, 수원 26.6℃로 철원이 수원에 비해 2.1℃ 낮았다. 따라서 수원은 철원에 비해 상대적으로 벼의 등숙기 온도가 높은 재배지역임을 확인할 수 있었다.
쌀 완전미율 및 식미 관능평가 차이
공시한 8 품종 조생종 벼 품종들의 출수기, 정현비율 및 완전미율은 Table 2와 같다. 지역 간 8 품종 벼의 출수기는 수원이 철원보다 평균 7일 늦었으며, 8개 품종 모두 7월 중에 출수가 완료되어 등숙기 고온 환경에 의한 지역 간 쌀 품질 비교에 적합하게 벼가 재배되었을 것으로 추정되었다. 철원 및 수원 지역에서 재배된 시료의 쌀 품질분석 결과, 정현비율 및 쌀 완전미율 모두 수원 재배 시료에서 유의하게 낮았고, 그 이유는 수원지역의 상대적 고온 환경이 조생종 벼 등숙에 영향을 주었기 때문으로 해석되었다(p %#60; 0.01).
중북부 산간지역인 철원과 중부 평야지역인 수원에서 재배한 조생종 8 품종 시료의 식미 관능평가를 수행한 결과(Table 3), 식미 관능 총평은 등숙기 고온 조건인 수원에서 생산된 시료는 철원에서 생산된 시료에 비해 식미 총평이 유의적으로 낮았다(p < 0.01). 또한 식미관능평가 5개 항목에 대한 지역 간 t-test 분석 결과에서도 수원 시료가 철원 시료에 비해 밥의 향기는 5% 수준, 그 외 4개 항목 은 1% 수준에서 유의적으로 낮게 평가되었다. 이와 같이 등숙기간 동안 상대적 고온 조건이었던 수원 재배 시료는 철원 시료에 비해 쌀 완전미율 및 식미 관능평가 점수가 낮게 평가되어 고온등숙 조건에서 쌀의 외관품질 및 식미가 감소하였다는 최 등(Choi et al., 1994; Chun et al., 2015; Lee et al., 2008; Lee et al., 2012)의 선행 연구결과와 유사하였다. 따라서 철원과 수원에서 재배 된 시험재료는 조생종 벼의 평야지 조기재배에 따른 등숙기 고온 환경에 의한 전분구조 및 종자 저장단백질 특성 차이를 비교분석하려는 본 시험의 목적에 적합하게 재배되었음을 간접적으로 알 수 있었다.
전분구조 특성 차이
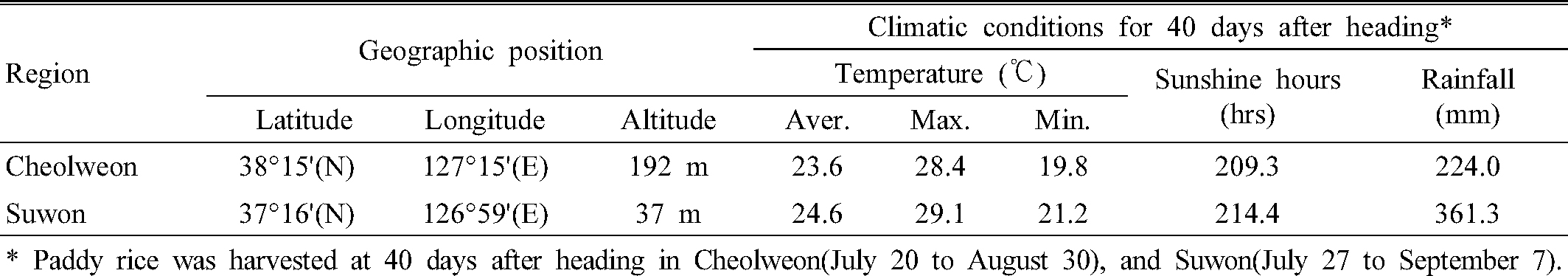
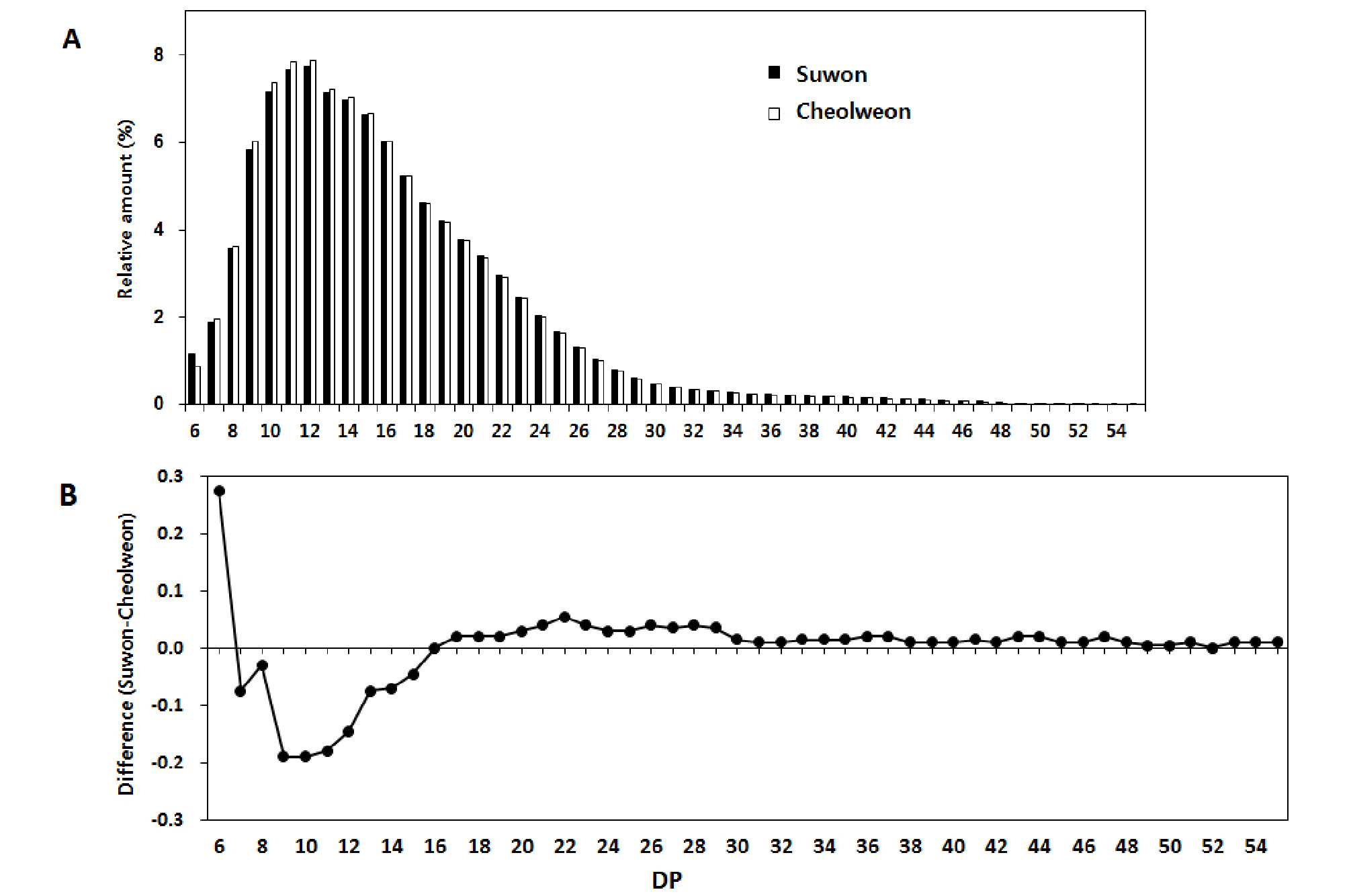
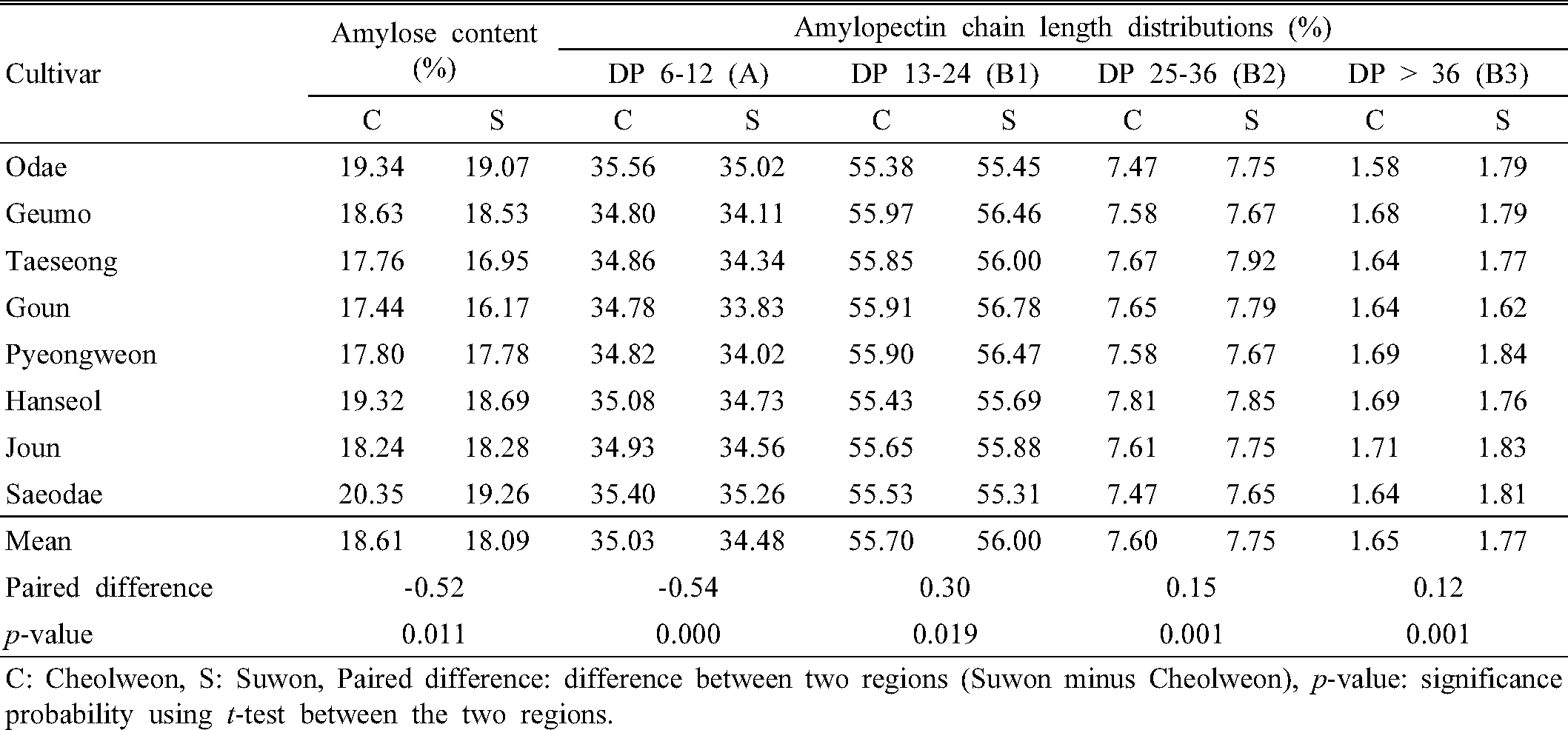
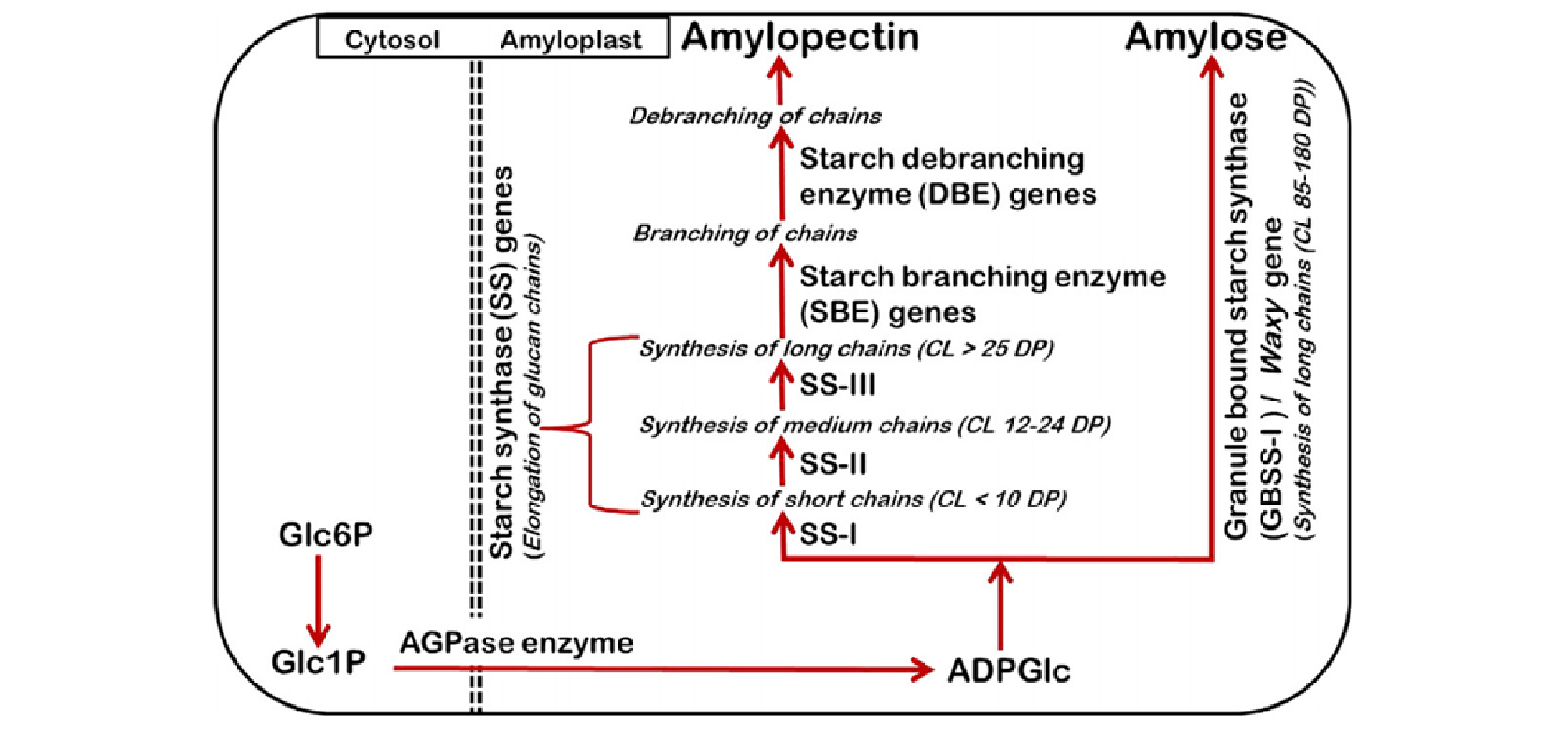
철원과 수원의 지역 간 아밀로스 함량과 아밀로펙틴 측쇄 사슬길이 분포 차이 분석 결과는 Fig. 1 및 Table 4와 같다. 전분은 아밀로스와 아밀로펙틴으로 구성되어 있으며, 국내 밥쌀용 품종 대부분은 아밀로스 20% 이하, 아밀로펙틴 80% 이상으로 구성되어 있어 아밀로펙틴의 구조적 특성이 중요한 품질 결정 인자로 작용할 것으로 추측할 수 있다. 철원과 수원 시료의 전분 특성을 분석한 결과, 상대적으로 고온등숙 조건이었던 수원 시료의 아밀로스 함량이 유의적으로 낮았다(p = 0.011). 또한 전분의 구조적 특성 평가를 위해 아밀로펙틴 측쇄 사슬길이에 대한 중합도(Degree of polymerization, DP)를 측정한 결과, 수원 시료는 철원 시료에 비해 단쇄 사슬길이(DP 6-12) 비율은 낮은 반면 중쇄 사슬(DP 13-24) 및 장쇄 사슬(DP > 24) 비율은 높았다(Table 4). 전분의 중합도는 glucose의 개수를 나타내며 일반적으로 DP 10-12이하를 단쇄 또는 A 사슬, DP 12-24를 중쇄 또는 B1 사슬, DP 25 이상을 장쇄 또는 B2/B3 사슬이라고 한다(Pandey et al., 2012). 본 연구의 지역 간 시료의 비교 결과, DP 13-24의 중쇄 사슬 비율 차이는 5%, DP 25 이상의 장쇄 사슬 비율 차이는 1% 수준에서 유의성이 인정되었다. 이상의 결과와 같이 등숙기 고온 조건 시료(수원)에서는 아밀로스 함량이 감소되었고, 아밀로펙틴 단쇄 사슬의 합성은 저해된 반면, 장쇄 사슬의 합성은 상대적으로 촉진되었음을 확인하였다. 벼의 고온등숙 관련 선행연구에 의하면, 고온등숙 조건에서 전체 아밀로스 함량은 감소하나 장쇄 아밀로스(MW 107.1 to 107.4)의 비율은 높았다는 결과가 보고된 바 있고(Zhang et al., 2016), 고온 조건에서 아밀로펙틴의 단쇄 사슬(A-사슬) 비율은 감소하고, 장쇄 사슬(B2/B3-사슬)은 증가하였다는 연구 결과들(Chun et al., 2015; Zhang et al., 2016; Yamakawa et al., 2007)도 있다. 이러한 아밀로스 함량 감소와 아밀로펙틴 측쇄 사슬길이 분포 차이는 아밀로스 합성유전자(GBSSⅠ(Wx), 아밀로펙틴 단쇄 사슬 합성유전자(SSⅠ), 아밀로펙틴 가지합성유전자(SBEⅡb)의 활성 및 발현 감소와 관련이 있다고 알려졌다(Yamakawa et al., 2007). 특히 아밀로펙틴 단쇄 사슬 합성유전자(SSⅠ)는 중·장쇄 사슬합성에도 제한적으로 관여하며, 전체 아밀로펙틴 사슬길이 합성유전자(SS) 활성의 60-70%를 차지할 정도로 그 역할이 크다고 언급된 바 있다(Bao et al., 2008).
Table 4. Amylose contents and amylopectin chain length properties of rice samples from different regions. |
|
본 시험결과와 선행연구를 고찰한 결과, 조생종 벼의 평야지 재배에 따른 등숙기 고온 조건으로 인한 지역 간 쌀 품질은 전분의 구조적 특성에서 차이를 나타냈으며 특히, 아밀로펙틴의 단쇄 사슬길이 분포 차이가 큰 것을 알 수 있었다. 따라서 유사한 단백질 및 아밀로스 함량에도 불구하고 밥의 찰기와 질감 차이를 나타낸다면 장쇄 아밀로스 및 아밀로펙틴 단쇄 사슬길이에 대한 추가적인 고찰을 통해 쌀의 성분을 구명하는 연구가 필요할 것으로 사료된다. 뿐만 아니라, 고온등숙 조건에서의 아밀로스 합성유전자(GBSSⅠ), 아밀로펙틴 단쇄사슬 합성 유전자(SSⅠ), 가지 합성 유전자(SBEⅡb) 등 전분 합성 관여 유전자들(Fig 3)의 활성 및 발현 조절, 그리고 유전자 부위의 염기서열 비교 등에 대한 세부적인 연구도 필요할 것으로 사료된다.
저장단백질 특성 차이
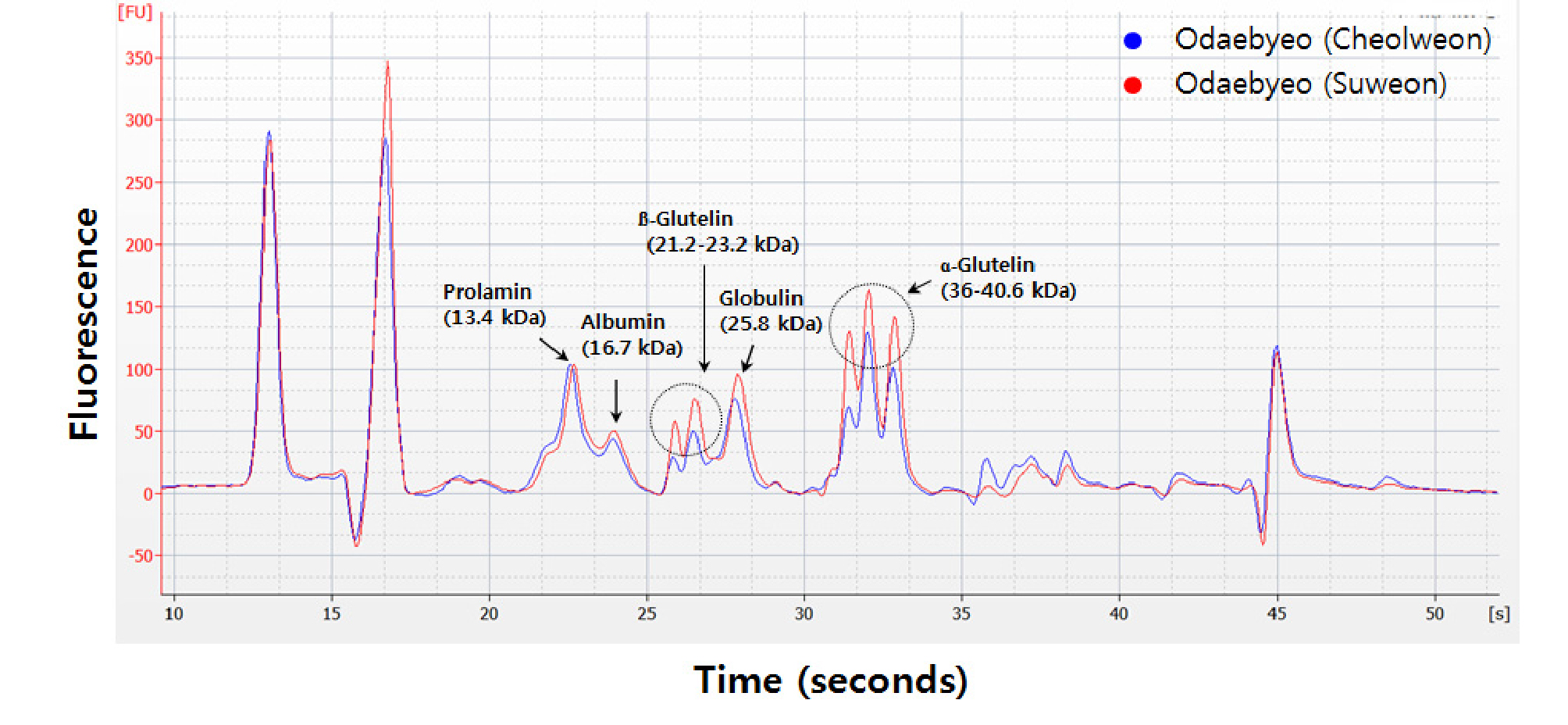
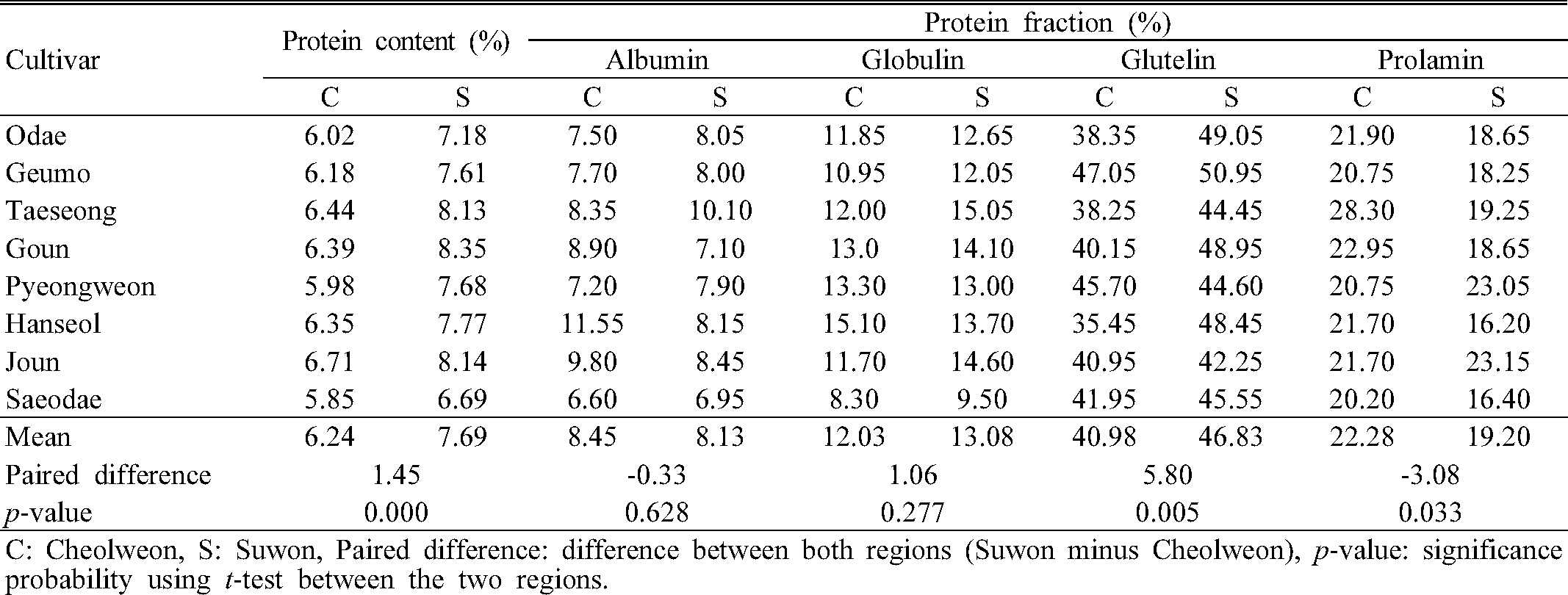
철원과 수원에서 재배된 쌀의 단백질 함량 및 저장단백질 조성은 Table 5과 같았고 등숙기 고온 조건이었던 수원 시료의 단백질 함량이 철원 시료에 비해 고도로 유의하게 높았다(p < 0.01). 본 연구에서 사용한 Bioanalyzer를 이용한 전기영동법은 기존의 SDS-PAGE 전기영동법과 유사한 결과를 나타내며 정밀한 분석이 가능하다고 보고된 바 있으며(Kwak et al., 2016), 철원 및 수원에서 재배한 쌀 시료의 저장단백질 분석 결과, 알부민(약 16.7 kDa), 글로부린(약 25.8 kDa), 글루텔린의 염기성 유닛(약 21.2-23.2 kDa)과 글루텔린 산성 유닛(약 36-40.6 kDa), 그리고 프롤라민(약 13.4 kDa) 조성을 분석하였다(Fig. 2). 쌀의 저장단백질은 알부민, 글로부린, 글루텔린 및 프롤라민 등 4개 성분으로 구성되어 있으며(Li & Okita 1993; Tanaka et al., 2005), 글루텔린은 합성 초기에는 약 57 kDa 크기의 전구체 상태였다가 등숙후기에 효소 작용에 의해 산성(34-39 kDa)과 염기성(21-22 kDa) 유닛으로 분리된다고 보고되어 있다(Hari & White, 1995). 재배지역 간 쌀 저장단백질 조성 분석 결과, 알부민과 글로불린의 비율은 차이가 없었으나, 글루텔린과 프롤라민에서 차이를 나타냈는데 등숙기 고온 조건의 수원 시료는 철원 시료에 비해 글루텔린 비율은 높은 반면(p < 0.01), 프롤라민 비율은 낮았다(p < 0.05) (Table 5). 글루텔린의 세부적인 조성차이 비교를 위해 산성과 염기성 서브유닛을 분석한 결과는 Table 6과 같다. Tran 등(Tran et al., 2014; Muhammad et al., 2011)은 쌀의 산성 글루텔린을 α-1 (39 kDa) 에서 α-4 (33-34 kDa)까지 네 개 서브유닛, 염기성 글루텔린은 β-1 (23 kDa)에서 β-3 (22 kDa)까지 세 개 서브유닛으로 분리된 결과를 보고하였다. 그러나 본 시험에서는 산성 글루텔린은 α-1(약 36 kDa), α-2(약 37.7 kDa), α-3(약 40.6 kDa)의 세 개 서브유닛으로, 염기성 글루텔린은 β-1(약 21.5 kDa) 및 β-2(약 23.2 kDa)의 두 개 서브유닛으로 분리된 결과를 확인하였다. 본 시험에서 확인한 서브유닛의 범위는 위에서 언급한 선행연구의 서브유닛의 분자량 범위를 모두 포함하는 결과로, 단백질 검출 범위가 유사하였다. 등숙기 고온 조건이었던 수원 시료와 철원 시료의 글루텔린 조성을 비교한 결과, 염기성 글루텔린의 비율은 두 지역 간 통계적인 차이가 없는(p = 0.06) 반면, 산성 글루텔린은 수원 재배 시료에서 통계적으로 유의 하게 높았다(p = 0.001). 특히 수원 재배 시료에서 산성 글루텔린 비율이 높게 나타난 결과는 산성 글루텔린의 3개 서브 유닛 중, α-1(약 36 kDa)과 α-3(약 40.6 kDa)의 비율 차이가 큰 영향을 미친 것으로 보인다. Lin 등(Lin et al., 2010; Yamakawa et al., 2007)의 고온등숙 관련 선행연구에서는 고온등숙 조건에서 4 종의 저장단백질 중 분자량 13-14 kDa의 프롤라민이 감소되었고 글루텔린의 비율은 증가하는 경향을 나타내었다고 하여 본 연구와 유사한 결과를 발표하였다. 그러나, 본 연구에서 등숙기 고온 조건인 수원 재배 시료에서 산성 글루텔린 서브유닛인 α-1(약 36 kDa) 및 α-3(약 40.6 kDa) 비율이 유의하게 높은 현상과 관련해서는 기존의 선행문헌을 찾지 못했으며 이 부분에 대해서는 추가적인 검토가 필요할 것으로 고찰되었다.
한편, 쌀의 저장단백질은 식미에 영향을 주는 것으로 알려져 있는데, Nam & Kim(1996)은 쌀의 프롤라민/글루텔린 비율이 높을수록 식미가 양호하다고 발표하였고, 자포니카와 통일형 벼 품종의 식미 관련 저장단백질 연구를 하였던 Kwak 등(Kwak et al., 2016)도 식미 특성이 떨어지는 통일형 품종에서 산성 글루텔린의 서브유닛인 α-1(35.9∼36.8 kDa) 비율이 유의적으로 높다는 결과를 발표하였다. 이와 같은 측면에서 본다면, 본 연구 결과와 같이, 등숙기 고온 조건인 수원 시료가 철원 생산 시료에 비해 식미 관능평가 총평이 유의하게 낮고, 저장단백질 특성 분석 결과에서도 수원 시료의 프롤라민/글루텔린 비율이 낮은 결과로 미루어 볼 때, 두 지역 간의 저장단백질 조성 차이가 식미 결과에도 영향을 미쳤을 것으로 추측 해 볼 수 있다. 그러나, 등숙기 온도 차이에 의한 성분 및 식미저하의 상관성 분석은 향후 세밀한 검토가 필요할 것으로 생각된다.
적요
본 시험은 조생종 벼의 평야지 재배에 따른 등숙 온도 차이에 의한 전분구조와 종자 저장단백질 특성 차이를 평가하여 쌀 품질향상을 위한 기초자료 제공을 위해 수행하였다. 이를 위해 조생종 벼 8 품종을 철원 및 등숙기 온도가 상대적 고온 조건인 수원에서 재배하여 품질 분석을 수행하였다.
등숙시 고온 조건에서는 일반 조건보다 쌀 완전미율, 아밀로스 함량, 식미총평 점수가 낮은 반면 단백질 함량은 높았다. 전분구조 특성 차이를 평가한 결과, 고온 조건에서는 일반 조건에 비해 아밀로펙틴의 단쇄 사슬길이(DP < 12) 분포비율이 낮은 반면, 중쇄(DP 13-24) 및 장쇄사슬 길이(DP > 25) 분포비율은 높았다.
저장단백질 특성 차이를 평가한 결과, 등숙기 고온 조건의 시료에서는 알부민과 글로불린 함량에는 차이가 없는 반면, 글루텔린 함량은 높고, 프롤라민 함량은 낮았다. 글루텔린의 서브유닛을 분석한 결과, 염기성 글루텔린 조성은 두 지역 간 차이가 없었으나 산성 글루텔린은 등숙기 고온 조건에서 유의하게 높았으며, 특히 α-1(약 36 kDa)과 α-3(약 40.6 kDa) 서브유닛의 함량이 높았다. 선행연구에서 고온등숙 조건에서 프롤라민의 감소는 보고가 되었으나, 산성 글루텔린 증가와 관련된 사항은 현재까지 보고된 바가 없어, 향후 이 부분에 대한 추가 검토가 필요할 것으로 고찰된다.