서언
수발아는 종자가 발아력을 갖추기 시작한 이후에 휴면성이 약해지면서 이삭에서 발아하는 현상을 말한다. 벼의 수발아는 등숙 단계로 보면 대체로 황숙기 이후 발생하기 시작한다(Park & Park, 1984). 수발아성은 종자의 휴면정도와 관련이 높기 때문에 생태형 및 품종간 차이가 크게 나타나는데 자포니카형 품종이 인디카형 및 통일형보다 수발아가 잘되며(Lee et al., 2016; Lee et al., 2006; Suh & Kim, 1994) 우리나라와 같은 온대지역에서는 벼 등숙기에 발생하는 태풍이나, 고온과 잦은 강우를 동반하는 이상기상으로 인해 수발아 피해가 발생하고(Park & Kim, 2009; Suh & Kim, 1994), 중국 남부지역 및 동남아시아에서는 초여름부터 가을까지의 긴 우기에 발생하기 쉽다고 하였다(Wan et al., 2006). 최근 국내에서 발생한 수발아 피해를 보면 2016년에 벼 수확기의 잦은 강우, 고온 등으로 전북 3,506 ha, 전남 11,216 ha, 경북 13 ha, 경남 42 ha, 부산 46 ha 등 14,823 ha의 논에서 피해가 발생하였다(농림축산식품부 보도자료, 2016.11.8.). 벼 수발아가 발생하면 수량이 감소할 뿐만 아니라 품질이 크게 떨어지므로 농가의 경제적 손실이 크며(Kim et al., 2008; Oh et al., 1987; Park & Kim, 2009), 한 번 수발아 된 종자는 발아율 및 입모율이 크게 떨어지므로 종자로 사용하기 어려워진다(Baek & Chung, 2014b; Shon et al., 2014).
이에 벼의 수발아 피해를 줄이기 위해 수발아 발생의 원인에 대한 생리생화학적 연구 외에도 수발아 내성 품종의 육성, 경감 재배기술 개발 등 다양한 분야에서 연구가 수행되고 있다. 벼 종자의 발달과 휴면 그리고 발아에 관한 수많은 연구가 수행되어 ABA, GA, Ethylene 등 식물호르몬의 역할 및 조절 기작을 밝혀내고 있으며(Arc et al., 2013; Gubler et al., 2005; Kaneko et al., 2002; Kang et al., 2015; Kim, 1995; Liu et al., 2014; Shu et al., 2016; Shu et al., 2015), 벼 발아에 관여하는 단백질체 분석 연구(He & Yang, 2013; Liu et al., 2016), 그리고 벼 출수 후 경과일수와 벼 이삭에서 볍씨의 착생 위치에 따라 수발아율이 달라진다는 생리생태적인 연구 결과 등이 보고된 바 있다(Baek & Chung, 2014a; Suh & Kim, 1994). 종자의 휴면과 수발아성에 대한 양적형질(QTL) 유전자를 탐색하고, 수발아를 억제하는 유전자(OsPHS1 등)를 활용하기 위한 유전적인 연구가 수행되고 있다(Huh et al., 2013; Magwa et al., 2016; Wu et al., 2016). 최근 육성된 MS11의 경우 편친인 진미벼보다 내수발아성이 향상되었으나 인디카와 통일형 품종 보다는 수발아성이 높은 편이므로 열대지역에서 고품벼질 자포니카형 품종의 재배를 위해서 내수발아성이 품종 개발이 요구된다고 하였다(Lee et al., 2015). 재배기술에 관한 연구로는 재배시기 및 수확시기, 일장 및 온도가 수발아의 발생에 영향을 미치므로 수발아 발생을 줄이기 위해 이앙기 조절, 적기 수확, 다비밀식 주의, 생장조절제 처리 등의 재배적 관리가 필요하다고 하였다(Cho et al., 1987; RDA, 2015).
벼의 수발아성을 검정하는 방법은 포장검정(도복 유인, 인공강우 처리)과 실내검정(채취 이삭의 발아처리)으로 구분되는데, 실내검정은 이삭 채취 시기, 처리온도 및 항온 또는 변온 여부, 처리 일수 등 검정 조건이 다양하다. Ju et al. (2000)은 출수 후 45일에 25/15℃의 변온을 갖는 항온항습기에 이삭을 치상하여 6일 후 조사하는 실내검정방법이 품종별 수발아 변이를 가장 잘 확인할 수 있으며, 포장검정과 고도의 정상관을 보이므로 효율적인 검정방법이라고 하였다. Park & Kim (2009)은 20여 품종을 공시하여 실내검정 방법과 포장에서의 검정방법(도복 유인, 분무처리)을 비교하였고, 출수 후 25일, 35일, 45일의 세 시기별로 품종별 수발아성을 구분하여 보고한 바 있다. 그런데 벼의 수발아성은 등숙환경의 영향을 크게 받음에도 기상조건에 따른 수발아성 변이에 관한 보고가 없으며, 현행 수발아 검정기준(RDA, 2012)은 출수 후 40일로 생태형에 상관없이 동일하므로 출수기가 다른 품종 간에 종자의 생리적 등숙 상태가 일정하지 않은 단점이 있다. 따라서 본 연구는 다년간 출수 후 적산온도에 따른 수발아 발생 양상의 품종간 차이와 변이 정도를 분석하고, 품종간 수발아성 차이의 생리적 요인을 구명하고자 수행하였다.
재료 및 방법
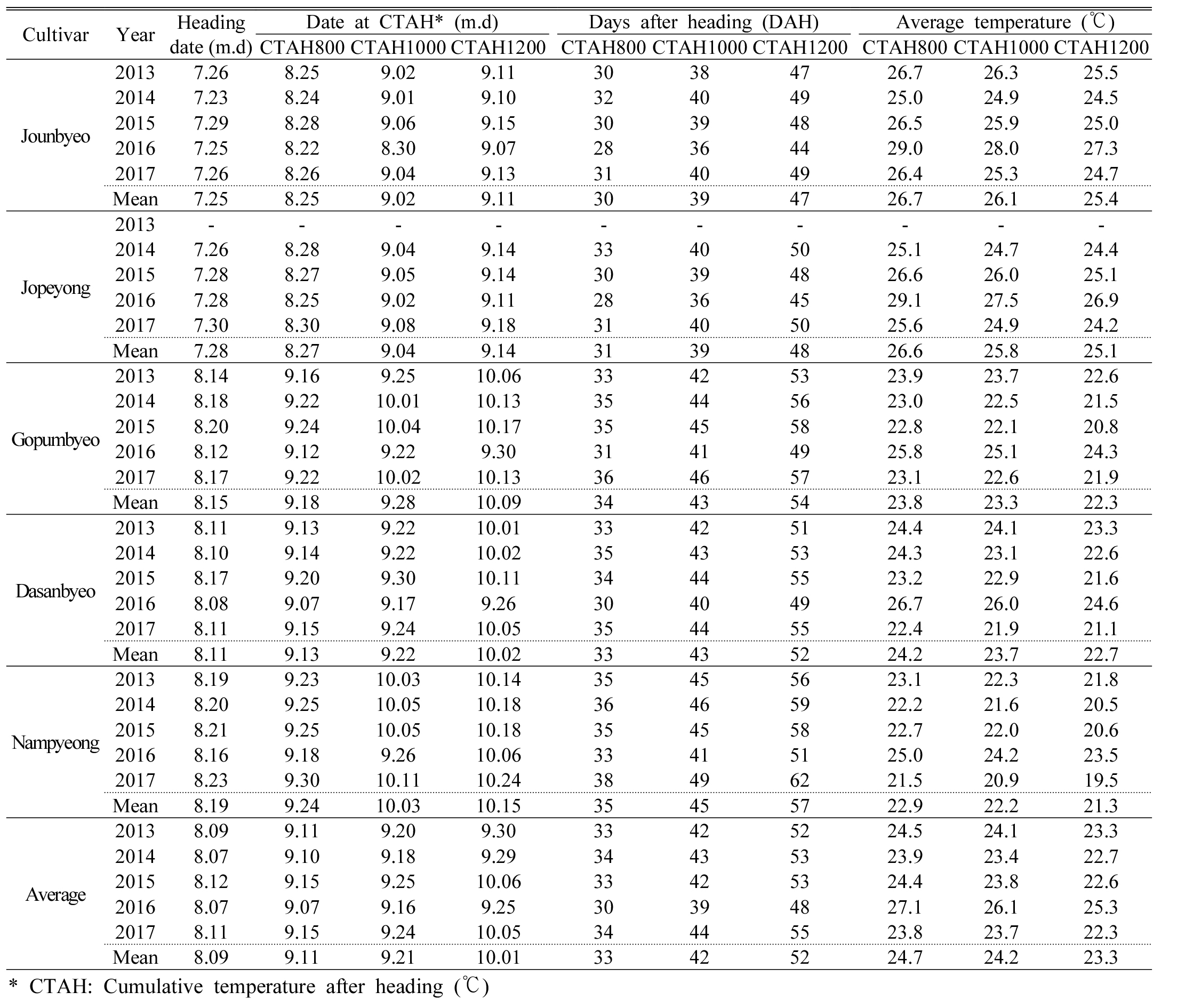
본 시험은 국립식량과학원 벼 시험포장에서 5품종을 공시하였는데, 조운벼, 고품벼, 다산벼 및 남평벼는 2013년부터 2017년까지 5년 동안, 조평벼는 2014년에 추가되어 4년 동안 시험하였다. 2013~2015년은 5월 1일에 파종하여 25일된 모를 5월 25일에 이앙하였고, 2016~2017년에는 4월 28일에 파종하여 30일된 모를 5월 28일에 기계이앙하였으며, 재식간격은 30×14 cm로 매년 동일하게 이앙하였다. 시비량은 질소-인산-칼리를 ha당 90-45-57 kg으로 주되, 질소는 밑거름 50%, 가지거름 20%, 이삭거름 30%로 나누어 주었으며, 인산은 전량 밑거름으로 시용하였고, 칼리는 밑거름 70%, 이삭거름 30%로 분시하였다. 가지거름은 이앙 후 15일에, 이삭거름은 출수생태형별로 구분하여 조생종은 7월 5일, 중생종은 7월 19일, 중만생종은 7월 24일에 주었다. 기타 재배관리는 농촌진흥청 표준재배법에 따랐다.
벼 품종별 등숙시기에 따른 수발아율 변이를 보기 위해 각 품종별 출수기에 추출 정도가 비슷한 이삭에 표식을 해두었다가 출수 후 적산온도 800, 1000, 1200℃되는 시점에 5개씩 채취하여 실내검정을 하였다. 실내 수발아 검정방법은 농업과학기술조사방법(농촌진흥청, 2012)에 따라 온도 25℃ 및 포화습도가 유지되는 항온기에서 7일간 처리하여 조사하였다. 포화습도 처리는 360×320×60 mm 크기의 스테인리스 트레이에 페이퍼타올(WYPALL L25 #41311, 6겹, 유한킴벌리)을 깔고 물을 충분히 적신 다음 그 위에 5이삭을 놓고 다시 단겹의 페이퍼타올을 덮어 수분이 충분히 유지되도록 하였다. 수발아율(%)은 발아립수/이삭의 전체립수×100으로 계산하였다.
출수 후 적산온도별 종자의 ABA 함량 변이를 분석하기 위해 수발아 검정시기와 같은 시기에 채취한 이삭을 사용하였다. ABA 추출은 Liu et al. (2007)의 방법을 따랐으며, 액체질소로 마쇄한 후 추출용매(25 mM KH2PO4, pH3:MeOH=2:8)를 넣고 30분간 진탕한 뒤 4℃에서 20분간 13,000rpm으로 추출한 용액을 speed vacuum concentrator로 용매를 증발시켰다. 남은 물질에 80% MeOH, 200 ㎕를 넣고 용해시킨 다음 정량에 사용하였다. 정량 분석은 한국기초과학지원연구원(서울)의 Triple Quadrupole LC-Mass spectrometry (Finnigan TSQ Quantum Ultra EMR)를 이용하여 분석하였다.
기상 분석은 기상청 수원 관측소(지점번호 119)의 일별 기상자료를 활용하였고, 통계분석은 R v.3.4.1 (R Core Team, 2017)을 이용하여 시험연도(5수준)를 주구, 품종(5수준)을 세구, 그리고 출수 후 적산온도(CTAH, 3수준)를 세세구로 하여 분산분석과 던칸의 다중범위검정으로 평균간 비교를 하였고, 요인과 수발아율간의 상관분석을 수행하였다.
결과 및 고찰
품종 및 연차간 수발아성 차이 비교
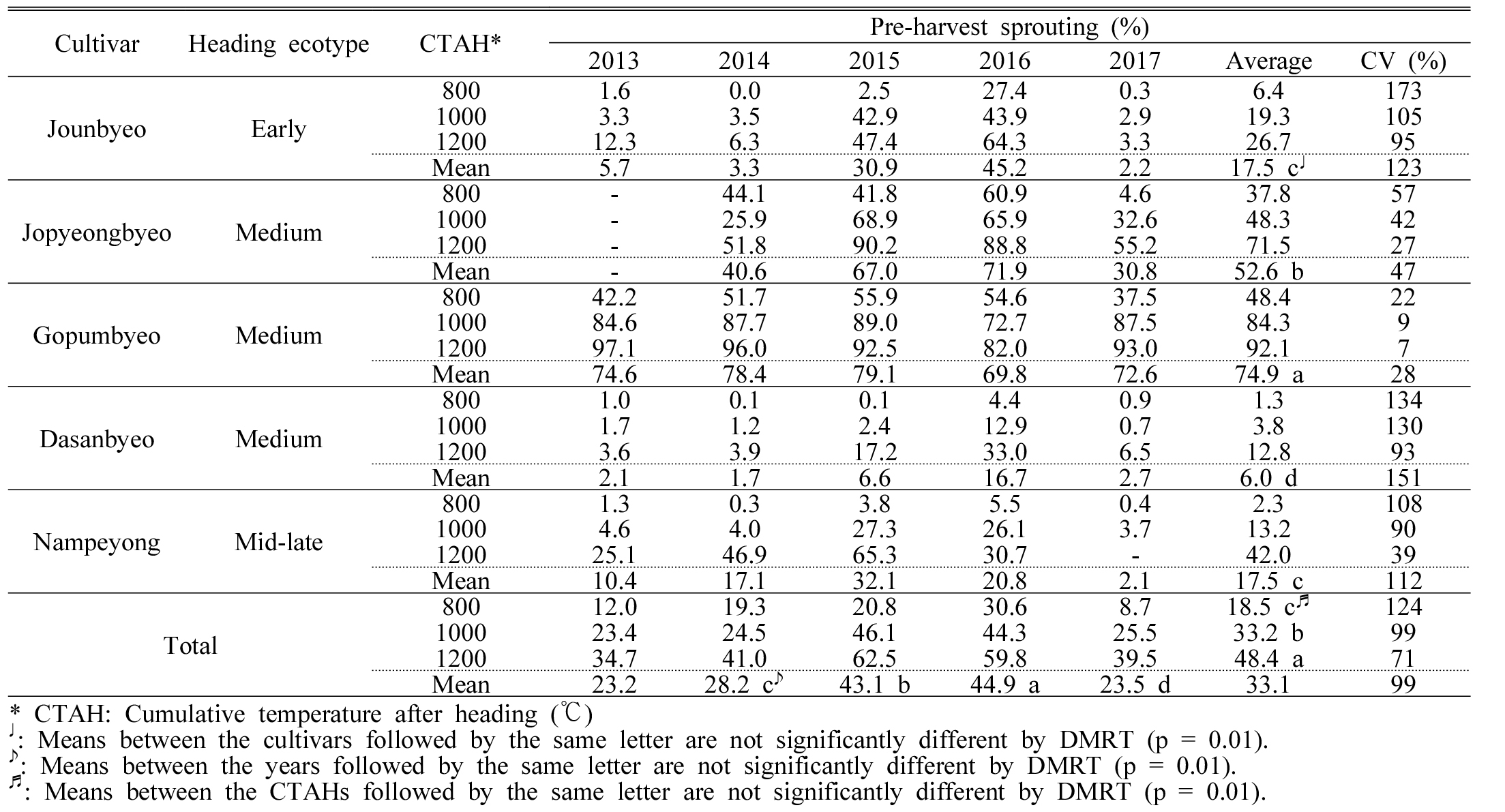
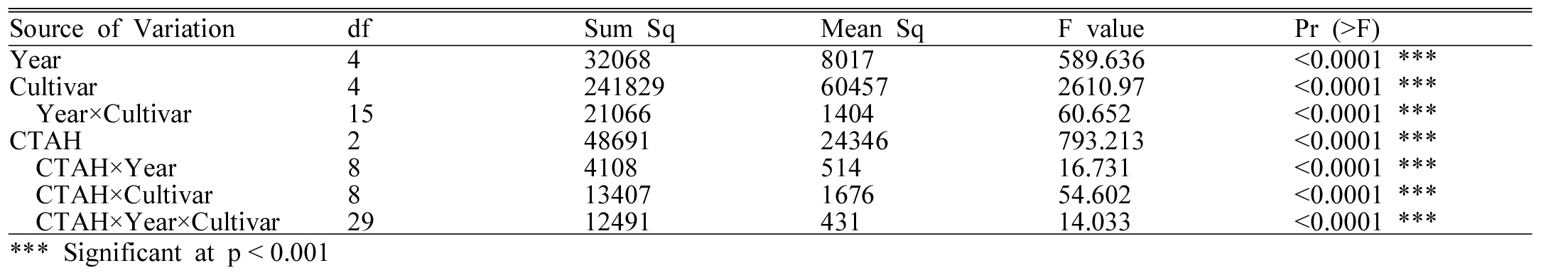
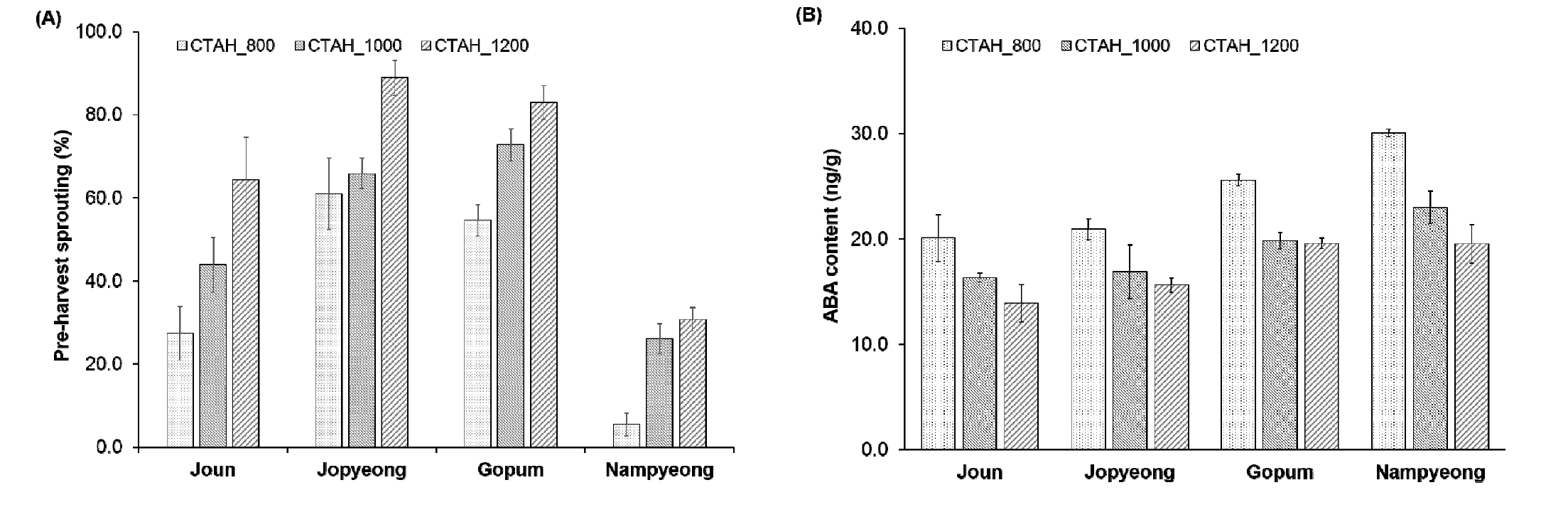
공시된 5개 품종의 5년 평균 수발아율을 보면 다산벼가 6.0%로 가장 낮았던 반면, 고품벼가 74.9%로 가장 높게 나타났다(Table 2). Table 3의 분산분석 결과를 보면 수발아율은 품종 간에 고도로 유의한 차이를 보이는데(p < 0.001), 출수 후 적산온도(CTAH) 및 시험연도와의 교호작용도 존재함을 알 수 있다. 고품벼는 CTAH1000℃ 기준에서 72.7~89.0%의 연차간 변이를 보였다. 수발아성을 보면 우리나라에서 재배되고 있는 품종은 대부분 자포니카형으로 인디카형에 비해 휴면성이 매우 약하며, 특히 조생종 품종은 휴면성이 없는 품종도 있다고 하였는데(KRRA, 2010), 중생종인 고품벼의 경우 휴면성이 매우 낮은 것으로 보인다(Fig. 1B). 또한 고품벼는 CTAH800℃에서부터 수발아율이 높은 것으로 보아 다른 품종에 비해 종자의 발아능력 획득 시기도 빠른 것으로 보인다.
조평벼의 4년 평균 수발아율은 52.6%로 CTAH1000℃ 기준에서 25.9~68.9%까지의 변이를 보였다. 2017년에 CTAH800℃에서처럼 수발아율이 매우 낮은 경우도 있으나, 대체적으로 조평벼도 고품벼처럼 종자의 성숙이 빠른 것으로 생각된다. 조평벼은는 2015년과 2016년에서처럼 CTAH1000℃의 수발아성이 42.9~43.9%로 급격히 높아지기도 하는 등 연차간 변이계수가(CV=105%) 남평벼(CV=90%)보다 높은 것으로 보아 남평벼보다 기상환경의 영향을 더 크게 받는 것으로 생각된다.
조운벼는 조평벼와 같은 조생종 품종임에도 수발아율이 17.5%로 낮은 수준이었으며, CTAH1000℃ 기준에서 2.9~43.9%의 변이를 보였다. 조운벼은는 CTAH800℃에서 수발아율은 6.4%로 매우 낮았는데, 이는 조운벼의 휴면성이 높은 것으로 보인다(Fig. 1A). 한편 2016년에는 CTAH800℃에서 27.4%로 시작하여 CTAH1200℃에서 64.3%로 수발아율이 매우 높았고, 2015년에는 CTAH1000℃에서 42.9%로 급격히 수발아율이 증가하였다. 다른 해에는 등숙이 진행되어 CTAH1200℃에 도달하더라도 수발아율이 3.3~12.3%까지 낮게 유지가 되는 것을 볼 때, 이는 2015년과 2016년의 기상 환경의 영향을 받아 발아를 억제하는 기작이 급격히 감소하였던 것으로 생각된다. 2016년의 기상조건을 보면 적산온도 CTAH800℃까지의 일평균기온은 29.0℃이었고, CTAH1000℃까지는 28.0℃로 시험기간 중 기온이 비교적 낮았던 2014년에 비해 각각 4.0℃와 3.1℃가 높았음을 알 수 있다(Table 1). 기온은 종자의 발달에 가장 큰 영향을 미치는 기상요소 중의 하나로써, 온도가 높을수록 천립중의 증가 속도가 빨라져 등숙기간이 짧아진다고 하였는데(KRRA, 2010), 실제 2016년의 경우 각 적산온도별 도달일수가 2014년에 비해 3~5일 빨라진 것을 알 수 있다.
Table 1. Heading date and sampling date for evaluation of pre-harvest sprouting in rice cultivars according to cumulative temperature after heading (CTAH). |
|
남평벼의 평균 수발아율은 17.5%로 다른 자포니카형 품종에 비해 수치가 낮았으며, CTAH1000℃ 기준에서 3.7~26.1%의 변이를 보였다. 남평벼의 경우 조운벼과와 마찬가지로 2015년과 2016년에 수발아율이 가장 높게 나타났다. 이 두 해의 남평벼의 수발아율은 CTAH1000℃에서는 27.3%와 26.1%로 조운벼의 60%정도 수준이었는데, 이는 남평벼의 출수기가 조운벼보다 대략 20일정도 늦어 등숙기간의 평균 기온이 22.0℃ 및 24.2℃로 보다 낮은 온도에서 등숙을 하였기 때문으로 생각된다. 따라서 남평벼는 CTAH800℃ 및 CTAH1000℃에 도달에 소요된 날수를 보면 조운벼보다 5일이 더 길었던 것으로 나타났다. 한편 CTAH1200℃에서는 높은 수발아율을 보였는데, 이는 남평벼의 등숙 후기 기온이 높고, 비가 내리는 기상환경의 영향 때문으로 판단된다. 실제 2016년의 경우 9월말~10월초 고온다습한 기상으로 인해 남부지역을 중심으로 수발아 피해가 심하게 발생하였다. 다산벼는 통일형 품종으로 다른 통일형 품종과 마찬가지로 CTAH1000℃ 시점의 수발아성이 3.8%로 매우 낮았다. 2016년에는 12.9%로 다소 높아지기도 하였으나 여전히 수발아성이 매우 낮았다.
벼 품종의 수발아성은 연차간에 뚜렷한 차이를 보였다(Table 2). 공시된 품종의 평균하여 볼 때 수발아율(CTAH1000℃ 기준)이 가장 높았던 해는 2016년(44.6%)과 2015년(44.3%)으로, 2014년(23.5%) 및 2017년(25.5%)에 비해 80% 가량 높게 나타났다. 2013년은 조평벼가 누락되어 있어 연차간 비교에서는 제외하였으나, 이 품종을 제외한 다른 품종의 수발아율 평균은 23.4%로 수발아율이 낮았던 두 해와 비슷하였다. 수발아율이 높았던 두 해의 기상환경을 보면 2016년에는 등숙기간 동안의 평균기온은 26.1℃로 5년 평균보다 1.9℃ 높고 비가 자주 내렸던 반면(Fig. 1D), 2015년은 23.8℃로 5년 평균보다 다소 낮았으나, 등숙 후기에 높은 기온을 경과한 것으로 나타났다(Fig. 1C). 등숙기간 동안의 일평균기온이 높으면 적산온도 또한 빠르게 증가하는데 CTAH1000℃에 도달하는데 소요되는 일수가 2016년에는 39일로 가장 빨랐고, 2017년에 44일로 가장 느리게 나타났다.
벼 수발아 발생에 있어 기온이 주로 종자의 등숙속도에 영향을 미친다면, 강수는 발아를 유도하는 조건으로 작용하는 것으로 보인다. 밀에서는 고온에서 등숙을 하게 될 경우 수발아율이 높아진다고 하였고, 등숙기간 중 기상요인 중 총강수량과는 상관이 없고, 종자의 성숙기 이후 평균기온이 높고 강우일수가 많을수록 수발아율이 높아진다고 하였다(Nakazono et al., 2013). 이는 대략 출수 후 25~30일이 경과하여 종자가 발아할 수 있는 능력을 가지게 되었을 때 기온이 높은 날 비가 자주 와서 이삭이 젖어 있는 상태에서 수발아가 발생할 수 있음을 의미한다. 그런데 밀의 수발아 발생과 관련하여 품종과 환경과의 상호관계가 있지만, 설명도가 6%로 매우 낮다고 하였다(Biddulph et al., 2008).
5년간 벼 품종의 수발아율 발생 양상을 보면 벼의 수발아성은 밀과 동일하게 기본적으로 기상환경보다는 유전적인 영향이 보다 큰 것으로 보이는데, 수발아에 강한 특성을 보이는 조운벼의 예와 같이 조생종 품종이라고 하더라도 휴면성과 관련된 품종의 내재적인 요인에 따라 수발아성의 차이가 크다고 할 수 있겠다. 벼 품종의 수발아성 평가 기준을 보면 Park & Kim (2009)은 출수 후 45일에 수확한 이삭의 수발아율이 10%이하를 나타낼 경우 수발아 내성품종이라고 하였는데, 본 시험에서는 통일형 중생종인 다산벼가 이에 해당한다고 볼 수 있다. 자포니카형 품종 중에서는 수발아율이 20%이내인 조생종 조운벼와 중만생종 남평벼를 수발아에 강한 품종이라고 구분할 수 있을 것으로 생각된다.
출수 후 적산온도별 수발아성 차이 비교
품종간 차이는 있으나 전체 공시품종에 걸쳐 공통적으로 출수 후 적산온도가 증가할수록 수발아성이 높아졌다(Table 2, 3). 이는 종자의 발아정도는 품종에 관계없이 볍씨의 성숙 정도에 따라 증가하는 경향을 보인다는 여러 보고와 같다(Park & Kim, 2009; Suh & Kim, 1994). 적산온도에 따른 수발아율은 공시품종 전체의 평균으로 볼 때 CTAH800℃에서는 18.5%, CTAH1000℃에서는 33.2%, 그리고 CTAH1200℃에서는 48.4%이므로 적산온도 200℃가 증가할 때 수발아율은 대략 14%씩 증가하는 것으로 볼 수 있다. 그러나 공시품종 전체를 대상으로 분석한 적산온도와 수발아율 사이의 상관계수는 R=0.357로 유의성이 나타나지 않았다(데이터 미제시). 이는 품종 간의 수발아율의 차이가 크고, 등숙이 진행됨에 따라 특정 시기에 수발아율이 크게 증가하기도 하므로 등숙기 적산온도와 수발아성의 관계는 일반적인 회귀식으로 표현하는 것이 어렵기 때문으로 보인다. 개별 품종을 보더라도 적산온도와 시험연도와의 강한 상호작용(p < 0.001)을 보이므로 정량적인 수식으로 표현하기 어려웠다.
Table 2. Pre-harvest sprouting rate by cultivar and cumulative temperature after heading (CTAH) in 2013–2017. |
|
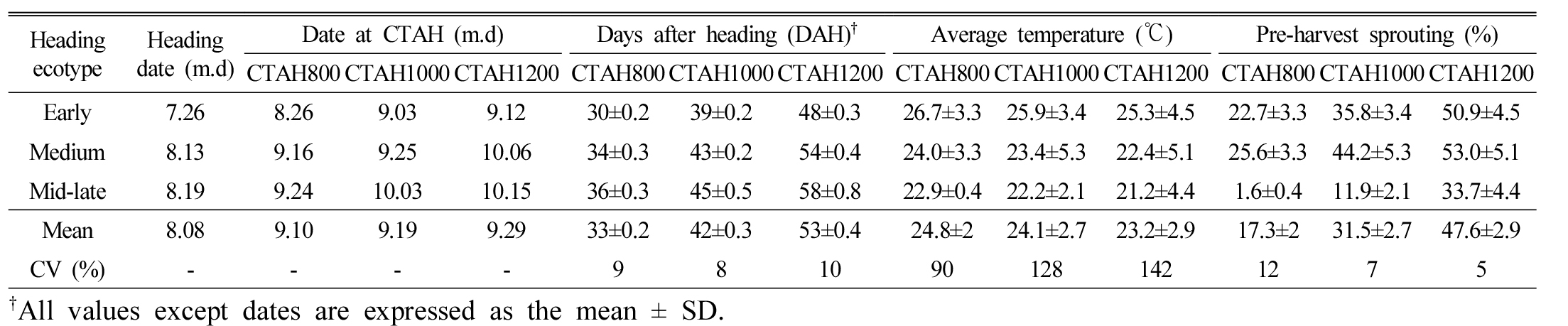
적산온도별 수발아성의 변이계수는 CTAH800℃에서 가장 컸고(124%), 등숙이 진행될수록 점차 감소하는 경향을 보였다. 출수기로부터 적산온도 800℃에 도달하는 시기는 30일(조생종)~35일(중만생종) 사이로 대략 출수 후 33일에 해당하며, 일부 빠른 품종을 제외하고 종자가 발아력을 갖추기 시작할 때이다(Table 1). 그런데 이 시기는 평균 수발아율이 17.8%로 일부 수발아성이 높은 품종을 제외하고는 수발아율이 매우 낮았기 때문에 변이계수가 크게 나타난 것으로 보인다. 따라서 이 시기는 품종별 수발아성 정도를 검정하는 시점으로 적절하지 않은 것으로 생각된다. CTAH1000℃에서는 품종별 평균 수발아율이 32%이고, 다산벼 3.5%부터 고품벼 84.0%까지 넓은 분포를 보인다. CTAH1200℃에서는 통일형 품종을 제외하고 대부분 20%이상의 높은 수발아율을 보였다. 적산온도 1200℃에 도달하는 기간은 조생종 47일~중만생종 57일로 벼 수확기(1100~1200℃)에 해당한다. 따라서 이 시기보다 품종간 변이계수가 높은 CTAH1000℃에서 품종간 수발아성 정도를 구분하기에 적당한 시점으로 생각된다. CTAH1000℃는 본 시험에서 평균적으로 출수 후 42일경으로 나타나는데, 조생종은 39일경, 중생종은 43일경, 중만생종은 45일경에 해당한다.
출수 후 40일 동안의 적산온도를 40일로 나눈 일평균기온의 평년(1981-2010) 추세를 보면 7월 10일~7월 21일까지 최고 25.8℃를 보였으며, 이후 서서히 낮아지는 추세를 보인다(Fig. 2F). 우리나라 주요 벼 품종은 극조생종을 제외하고 지역별 표준이앙시기에 재배할 경우 대부분 7월 21일 이후에 출수를 하게 되는데, 출수기가 빠를수록 출수 후 40일 동안의 적산온도가 높은 반면 출수기가 늦을수록 적산온도는 낮아지게 된다. 평년의 기상에 본 시험기간 동안의 공시품종별 평균 출수기를 대입하여 보면 조운벼의 경우 7월 25일에 출수하여 출수 후 40일에는 적산온도 1023℃에 도달하고, 중생종인 고품벼는 8월 15일에 출수하여 918℃에, 중만생종인 남평벼는 8월 19일에 출수하여 889℃에 도달하였다. 또한 중부지역의 안전등숙 출수한계기인 8월 30일에 출수를 할 경우에는 적산온도 803℃에 도달한다. 따라서 출수 후 40일을 기준으로 수발아를 검정하게 되면 적산온도가 최고 1033℃에서 803℃까지 범위가 넓기 때문에 출수기(또는 출수생태형)별로 종자의 등숙정도가 다른 상태에서 수발아성을 평가하게 된다.
벼 종자의 등숙 속도와 기간은 온도에 따라 크게 달라진다. 출수기가 빠른 품종의 경우 높은 온도에서 등숙을 하므로 종자의 발달 속도가 빠르고 등숙기간이 짧은 반면, 출수기가 늦은 품종의 경우 보다 낮은 온도에서 등숙이 진행되어 종자의 발달 속도가 완만하지만 등숙기간이 길어진다. 등숙기간에 고온을 경과하는 경우 종자의 생리적 성숙이 빠르고 휴면성이 일찍 소거될 수도 있으므로 출수 후 일수를 기준으로 수발아성을 검정할 경우 조생종은 수발아성이 비교적 높게 나타날 수 있다. 반대로 중만생종의 경우 기온이 낮아 종자의 생리적 성숙에 더 많은 시일이 소요되므로 수발아성을 낮게 평가할 경향이 있다. 따라서 출수 후 40일에 이삭을 채취하여 수발아성 검정하는 현 수발아 검정 방법의 경우 출수기에 따라 온도의 차이가 크다는 점과 등숙기간 기온이 높은 해와 낮은 해의 차이를 감안하지 못하는 단점이 있다. Ju et al. (2000)은 효과적으로 벼 수발아성을 검정할 수 있는 시기를 출수 후 45일경이라고 하였는데, 본 시험에서 적산온도를 기준으로 한 조생종의 검정 시기인 출수 후 39일보다 6일정도 등숙이 더 진행된 상태이므로 수발아성이 비교적 높게 나타날 수 있다. 한편 농촌진흥청 농업연구조사기준(RDA, 2012)에 따르면 벼 수발아성 검정은 출수 후 40일에 3이삭 이상을 채취하여 발아율을 조사하므로 본 시험결과와 비슷한 시기에 수행한다고 볼 수 있겠다. 다만 중만생종은 평년 기온 기준 적산온도 1000℃에 도달하는데 걸리는 일수인 43일 보다 이른 시기에 검정하게 됨으로써 수발아성을 낮게 평가할 가능성이 있다. 이러한 이유로 출수 후 적산온도가 수발아성 검정 시기 결정에 합리적인 기준이 될 수 있을 것이다. 그런데 적산온도를 기준으로 수발아 검정시기를 결정할 경우 일평균 기온의 경과를 꾸준히 지켜봐야 하고, 이에 따라 조사 일정이 달라지므로 작업일정 계획이 까다로워지는 현실적인 문제가 있다. 한편으로는 현행 벼 수발아성의 검정시기는 벼 표준재배 시기에 해당하므로 출수 후 일수를 기준으로 수발아율을 조사한 결과를 현장 활용하는 데에는 크게 문제가 되지 않을 것으로 보인다. 다만 내수발아성이 높게 평가된 품종이 벼 재배시기가 달라지거나 이상고온현상이 나타나 고온에서 등숙을 하게 되는 경우, 또는 잦은 강우 등의 불량기상 조건에서는 품종 특성으로 제시된 것보다 수발아율이 높게 나타날 수 있음을 염두에 두어야 할 것이다.
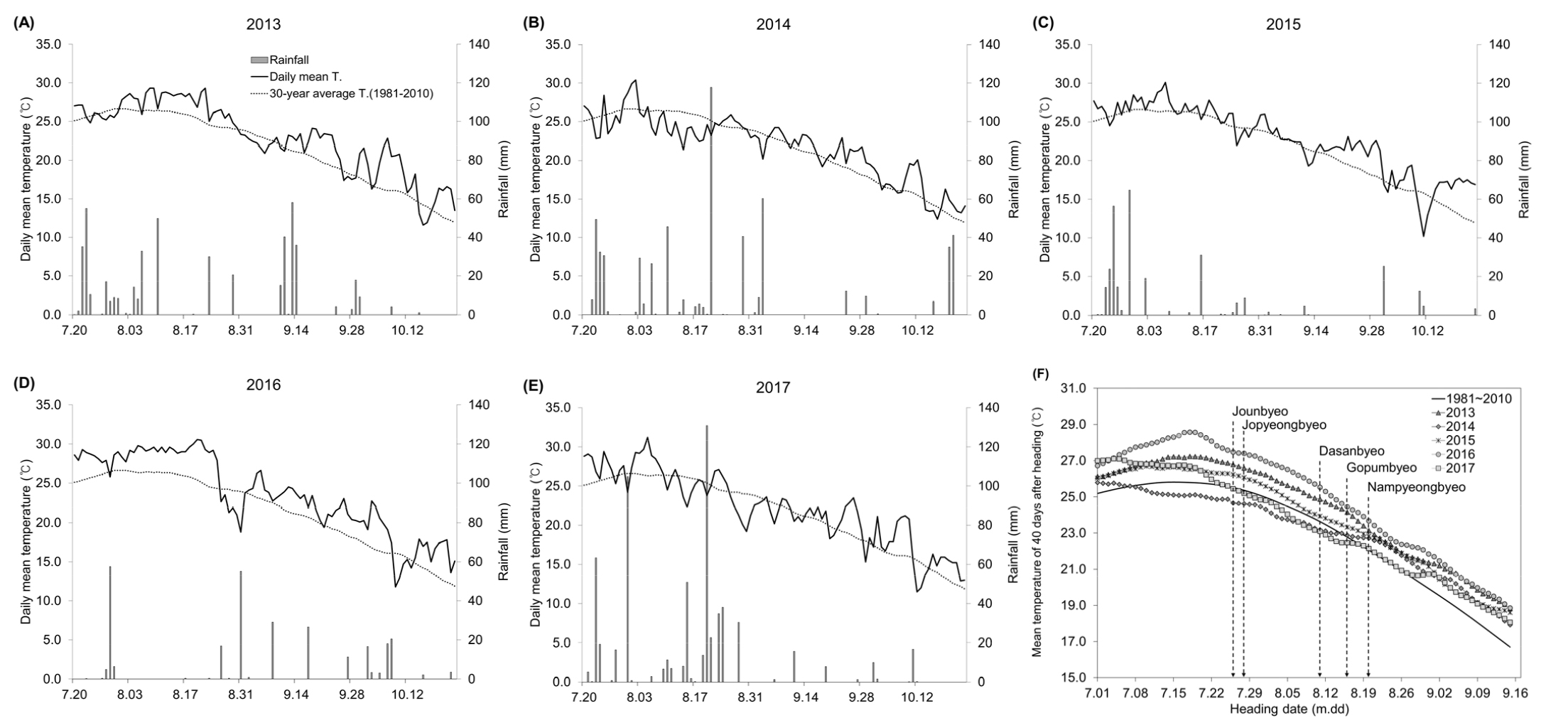
Fig. 2.
Daily mean temperature and rainfall during rice ripening periods in the experimental years (A-E). In the panels A-E, the daily mean temperature of the 30 years is repeatedly shown as a dotted line. Mean temperature of 40 days after heading (y-axis) on each heading date (x-axis) from 2013 to 2017 (F). Dashed arrows in panel F indicate the average heading dates for each cultivar for 5 years from 2013 to 2017, excluding Jopyeongbyeo (2014–2017).
출수생태형별 수발아성 비교
출수생태형별로 수발아성을 비교해보면 출수 후 적산온도에 상관없이 중생종 > 조생종 > 중만생종 순으로 나타났다(Table 4). 품종의 조만성에 따른 수발율은 대체적으로 조생종이 높다고 보고되어 있으나, 본 시험에서 중생종이 가장 높게 나타난 이유는 통일형인 다산벼의 수발아율이 매우 낮았음에도 불구하고 고품벼의 수발율이 특이적으로 높아 평균값을 견인하였기 때문이다. 본 시험에 공시된 품종은 수발아성이 높은 품종과 낮은 품종을 고려하여 선정하였고, 품종수도 5개로 적기 때문에 출수생태형간의 수발아율 차이를 대표하기 어려운 면이 있으므로 출수생태형별 수발아성의 차이를 비교하기 위해서는 다양한 품종과 유전자원을 대상으로 보다 폭넓은 검토가 필요할 것으로 생각된다. Lee et al. (2016)은 벼 유전자원 205점의 수발아성을 검토한 결과 출수기가 늦은 계통일수록 수발아율이 점차 감소하는 경향을 보였지만, 인디카형과 통일형 계통에서만 통계적으로 유의한 차이를 보인다고 하였다. 한편 Park & Kim (2009)은 중부지역에서 주로 재배되는 자포니카형 벼 20개 품종의 수발아율을 조사한 결과 일부 품종을 제외하고 조생종이 중생종보다 수발아율이 높다고 하였고, 다른 보고에서도 대체적으로 조생종의 수발아율이 중만생종보다 높은 경향을 보였다(Ju et al., 2000; Park & Park, 1984).
Table 4. Pre-harvest sprouting rates of tested rice cultivars grouped into different heading ecotypes. Data represent the average of 4 experimental years from 2014 to 2017. |
|
품종 및 적산온도별 ABA함량과 수발아성
2015년에 수확한 이삭의 수발아율을 보면 품종에 상관없이 적산온도가 높아질수록 수발아율은 증가하는 경향을 보이는데 반해(Fig. 3A), 종자내의 ABA 함량은 점차 감소하는 경향을 보였다(Fig. 3B). 본 시험에서 시료를 채취한 시점은 조운벼와 조평벼가 출수후 30~48일, 고품벼와 남평벼는 35~58일로, 벼 종자의 등숙 단계로 보면 황숙기~완숙기에 해당한다. 따라서 벼의 등숙 후기에는 등숙 정도와 ABA함량 사이에 부의 상관관계가 있다고 하겠다. Lee et al. (2016)은 벼 종실내 ABA 함량은 수정 후 3일경부터 급격히 증가하여 10일에 최고가 되며, 이후 감소한다고 하였고, Liu et al. (2014)이 벼 등숙 초기 및 중기에 ABA 함량이 높게 나타났다가 점차 감소한다고 보고한 결과와 같았다.
품종간 ABA의 함량과 수발아성과의 관계는 일정한 경향을 보이지 않았다. CTAH1000℃ 시점에서 수발아율이 높은 조평벼의 ABA 함량은 16.9 ng/g으로, 이보다 수발아율이 낮았던 조운벼의 ABA 함량(16.3 ng/g)과 유의한 차이를 보이지 않았다. 또한 수발아율이 가장 높았던 고품벼의 경우 수발아율이 가장 낮았던 남평벼보다 ABA 함량이 낮았지만, 조운벼와 조평벼보다는 높게 나타나 일관성이 없었다. Liu et al. (2014)은 ABA 함량과 품종간 수발아성 사이에 부의 상관관계가 있어 수발아성이 낮은 품종에서 ABA 함량이 높다고 하였고, Kim (1995)은 인디카와 통일형벼가 자포니카형 벼 품종보다 수발아율이 낮은 이유를 왕겨의 ABA 함량이 많기 때문이라고 보고하기도 하는 등 ABA의 함량이 수발아성을 감소시키는 방향으로 작용한다고 하였다. 그런데 본 시험의 결과를 보면 Lee et al. (2016)이 제안한 바와 같이 인디카형 계통은 수발아성이 낮은 품종에서 ABA 함량이 높았던 반면 자포니카형 계통은 반대의 경향이 나타나 ABA의 절대적인 함량 보다는 ABA 수용체나 신호전달 과정이 더 직접적인 영향을 끼칠 것이라는 가정이 더 설득력이 있다고 판단된다. 또한 벼 종자의 발달 과정에서 합성된 ABA가 휴면을 유지하는데 있어 중요한 역할을 하지만, ABA의 절대적인 함량보다 ABA와 GA 호르몬의 비율이 수발아성에 영향을 끼친다고도 하였다(Finch- Savage & Leubner-Metzger, 2006). 따라서 본 시험결과와 같이 ABA 함량이라는 하나의 요소만으로 벼 품종간 수발아성의 차이를 설명하기 어려울 것으로 보인다.
한편 식물호로몬의 생합성과 분해과정에는 환경의 영향이 크게 작용을 하는데(Fidler et al., 2015), 본 시험에서는 공시 품종을 동일한 날에 이앙을 하여 품종마다 출수기가 각기 달랐기 때문에 각 품종마다 등숙기 기상환경의 차이로 인해 ABA 함량이 달라질 수도 있다. 따라서 추후 품종별 ABA함량과 수발아성의 관계를 비교하기 위해서는 Lee et al. (2016)이 유전자원 계통간 ABA 함량을 비교하기 위해 출수기가 비슷한 시기의 계통을 선택하였던 것과 같이, 공시 품종의 재배시기를 달리하여 유사한 시기에 출수한 시료를 골라 분석함으로써 환경의 영향을 최소화할 필요가 있을 것으로 생각된다.
적요
본 연구는 2013~2017년에 벼의 출수 후 적산온도에 따른 수발아 발생 양상의 품종간 차이와 연차간 변이를 조사하고, 품종간 수발아성에 관여하는 생리적 요인을 구명하고자 수행하였으며, 그 결과를 요약하면 다음과 같다.
1. 벼 품종별 수발아율은 품종 간에 크게 차이가 났으며, 다산벼, 조운벼, 남평벼가 내수발아성이 강하였고, 고품벼와 조평벼는 수발아성이 높게 나타났다.
2. 벼 품종별 수발아성은 연도에 따라 발생정도가 다르게 나타났으며, 특히 2015년과 2016년에는 대부분의 품종이 높은 수발아율을 보였다. 등숙기 기상 조건에 따라 품종간 수발아의 발생 양상이 다르게 나타났는데, 유전적인 특성과 환경 조건의 상호작용이 컸기 때문으로 보인다.
3. 출수 후 적산온도가 800℃ 에서 1200℃로 증가할수록 수발아성은 높아졌다. 수발아 검정 시기를 출수 후 일수로 고정하는 것보다 등숙적산온도를 기준으로 하는 것이 기상 조건에 따른 종자의 생리적 발달 단계를 적절하게 반영할 수 있으며, 적산온도 1000℃에서 종자가 발아력을 충분히 갖추면서 품종간 변이계수가 큰 것으로 나타났다.
4. 출수 후 적산온도 800℃ 이후 적산온도가 증가함에 따라 ABA 함량이 점차 감소하는 경향을 보였다. 그러나 ABA 함량과 벼 품종의 수발아성은 유의한 상관관계를 보이지 않았다.